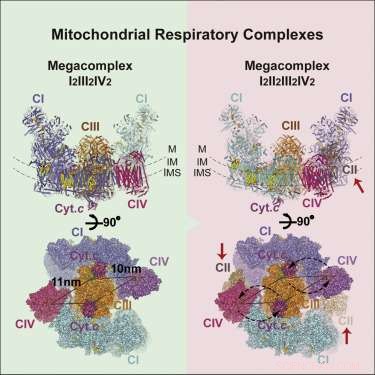
Estructura del megacomplejo respiratorio. Crédito: Celda (2017). DOI:10.1016 / j.cell.2017.07.050
(Phys.org):pieza por pieza, el diagrama del circuito para el transporte de electrones en las mitocondrias está más cerca de completarse. Cada nueva estructura obtenida para cualquiera de los cinco complejos respiratorios restringe aún más el rompecabezas ensamblado. Finalmente, los bloques grandes se organizan en sus ubicaciones finales. La composición exacta del bloque más grande, el llamado megacomplejo, ha eludido a los investigadores durante mucho tiempo. Ahora, después de obtener imágenes de 140 subunidades individuales con una resolución de 3.9 anstrom, el Full Monty ha quedado al descubierto. Los investigadores describen en Celda exactamente cómo se construye y parece funcionar el megacomplejo respiratorio humano.
Atrás quedaron los días simples. No más diagramas toscos con complejos alineados en la membrana en una fila del uno al cinco con electrones y sus portadores móviles viajando secuencialmente de izquierda a derecha. Trae la estequiometría, y trae el 2-D. La estequiometría significa que, en realidad, cada complejo está realmente representado en el megacomplejo con un número de copia específico. Estas copias adicionales deben ir a algún lugar en cualquier representación precisa. No solo eso, pero los portadores de electrones más pequeños necesitan un espacio para pasar el rato. También deben estar presentes dentro de los canales que permanecen locales al megacomplejo o posiblemente se difunden a otros. La geometría final dictará dónde se fusionan o bifurcan los caminos de electrones separados, y dónde es más probable que se ejecuten en reversa.
La imagen del megacomplejo (MC) que ha surgido tiene la siguiente estequiometría:MCI2II2III2IV2. Esto significa que los complejos I, II, III, &IV están presentes por duplicado, mientras que el complejo V está ausente. Está configurado dentro de la membrana en una estructura circular con el CIII dimérico ubicado en el centro y alimentado por complejos periféricos de CI y CIV. Aparentemente, los complejos CII no son requisitos esenciales para la estructura central, sino que se teoriza que se encajen en huecos según sea necesario. Los autores también encontraron evidencia de una interpretación ligera del megacomplejo que a veces se puede ensamblar con un solo complejo CI.
El posicionamiento central del dímero CIV sugiere cierta lógica. CIV, o citocromo oxidasa, es el terreno de reposo terminal para los electrones que entran en la cadena. Aquellos que llegan hasta aquí han sido rebajados en la jerarquía del potencial de reducción hasta donde pueden llegar. Aquí, están hundidos en moléculas de oxígeno en espera, que luego se agotan como moléculas de agua. Los electrones de alto potencial empaquetados como NADH ingresan al complejo por su perímetro y se canalizan hacia el centro. La ausencia de complejos C5 puede no ser tan inusual, considerando que se encuentran típicamente como filas de dímeros en forma de "V" que contorsionan la membrana en regiones de alta curvatura en las curvas de la cristea.
Con la estructura básica en la mano, los investigadores pudieron sugerir algunos principios básicos de funcionamiento. Su inclusión y ubicación de CII explica efectivamente el transporte de electrones inverso desde succinato a NADH. La geometría propuesta también crea un Q-pool sellado (un portador de electrones soluble en lípidos) que es accesible tanto para CI como para CII. Los autores también pudieron identificar la identidad y las ubicaciones de varias moléculas de lípidos que aseguran el complejo dentro de la membrana. específicamente, varias moléculas fundamentales de fosfatidiletanolamina, fosfatidilcolina, y cardiolipina. También pudieron identificar las rutas de transferencia de electrones preferidas o más eficientes, lo que a su vez restringe cuántos electrones se pueden transferir simultáneamente entre portadores activos.
Entre los beneficios inmediatos de este nuevo trabajo está que muchas de las mutaciones patógenas en proteínas respiratorias que antes no se entendían por completo ahora tienen sentido. Antes de tener una estructura megacompleja, Los investigadores no tuvieron más remedio que centrarse en cómo las mutaciones afectan la estructura o función de los complejos individuales. Como resulta, la mayoría de las mutaciones registradas en las subunidades centrales Ci y CIII diana están en residuos involucrados en sitios de interacción proteína-proteína entre complejos. (Por ejemplo, mutaciones asociadas a la enfermedad en las subunidades NDUFV1, NDUFS1, ND1, ND5, y ND6 en CI y subunidad MT-CYB en CIII). Esto muestra la inutilidad de tratar de mirar solo proteínas y subunidades individuales en ausencia de una imagen más amplia.
Cabe mencionar que los esfuerzos previos para definir la estequiometría del complejo respiratorio han obtenido resultados ligeramente diferentes dependiendo de qué órganos y especies se estudiaron. Patata, vaca, oveja, y levadura, que ni siquiera tienen un complejo de CI del que hablar, todos han sido estudiados. No es sorprendente que diferentes circunstancias puedan requerir diferentes estequiometrías y formas. Diferentes estructuras megacomplejas conllevarían diferentes ventajas para la canalización del sustrato, mejora catalítica, secuestro de intermedios reactivos, o estabilización estructural. Un estudio que analizó específicamente las mitocondrias del corazón estableció la proporción de los complejos de fosforilación oxidativa I:II:III:IV:V como 1:1.5:3:6:3. En este caso, los autores llamaron a su complejo el "respirasoma".
Con el megacomplejo respiratorio ahora presumiblemente agrietado, el siguiente gran paso hacia adelante es hacer estallar algunas de las otras superestructuras del sistema de doble membrana mitocondrial en modelos para predecir por qué las cristeas se ven como lo hacen. Los complejos de importación TIM-TOM masivos abarcan ambas membranas y están íntimamente asociados con los mitoribosomas que traducen las proteínas mitocondriales. Los mitoribosomas, Sucesivamente, se localizan en nucleoides subyacentes asociados a la membrana que albergan copias del mtDNA. A modo de analogía con el nucleolo del núcleo, esta estructura compuesta de nucleoide-ribosoma se ha denominado "mitocondriolo". Otros complejos de importación críticos se encuentran en la mezcla de jugadores que compiten por el espacio crítico de la membrana. El transbordador malato-aspartato, por ejemplo, es el transbordador más importante del cerebro y equilibra los principales metabolitos entre las mitocondrias y el citosol. La lanzadera citrato-piruvato para la síntesis de ácidos grasos y la lanzadera de fosfato de glicerol (al menos para la grasa parda y el músculo de vuelo de los insectos) también deben encontrar hogares donde puedan llevarse bien con los vecinos inmediatos.
La organización endémica de proteínas en estas megaestructuras sugiere que las mitocondrias podrían parecerse a un cristal duro más que a un protoplasma fluido. Pero de alguna manera, parecen extraordinariamente flexibles cuando se trata de fusión y fisión. ¿Qué sucede con la estructura de su membrana bajo este tipo de cambios? ¿Los complejos se desmontan y solubilizan temporalmente como el cilio primario y el centriolo de las células regulares durante la mitosis? Una nueva pista fascinante surge del trabajo que muestra que las mitocondrias se conectan entre sí a través de 'nanotúneles' de su propia construcción. Estos nanotúneles son completamente diferentes (hasta donde sabemos) de la marca de 'nanotubos tunelizadores infundidos en el citoesqueleto' que las propias células usan para transferir mitocondrias completas entre sí.
Una revisión reciente de Martin Picard y sus colegas en Tendencias en biología celular sugiere una forma en que estos nanotúneles podrían formarse cuando las mitocondrias se fijan al citoesqueleto. Si las proteínas motoras como la kinesina se apoderan de un parche de una mitocondria fija, podría sacar un nanotúnel delgado mientras la kinesina se mueve contra otro microtúbulo. El cuerpo rígido de la mitocondria y su estructura de membrana probablemente permanecerían intactos. Esta proyección podría encontrar otra mitocondria a la que se adhiera.
Picard mostró previamente que aproximadamente la mitad de las mitocondrias dentro del músculo cardíaco tienen uniones intermitocondriales (IMJ) y crestas que se alinean en patrones regulares que se extienden a través de las redes mitocondriales. Es poco probable que esta extraña alineación de la red surja de eventos de fisión recientes porque las mitocondrias del corazón están fijas en su lugar y muestran una dinámica mínima de fisión / fusión. Recientemente se ha demostrado que las IMJ controlan la contractilidad desacoplando rápidamente las mitocondrias unidas cuando sus propias membranas se despolarizan. Una cosa que sería de interés inmediato, aquí, es reexaminar la estequiometría de las subunidades respiratorias en las mitocondrias del corazón humano para complementar los resultados aquí reportados para las células renales embrionarias humanas.
© 2017 Phys.org