La barrera hematoencefálica bloquea la entrada de anticuerpos al cerebro. Esto limita el uso potencial de terapias con anticuerpos para tratar enfermedades cerebrales, como los tumores cerebrales.
En otras partes del cuerpo, los equipos médicos utilizan más de 100 anticuerpos terapéuticos aprobados por la Administración de Alimentos y Medicamentos de los Estados Unidos para tratar cánceres y enfermedades autoinmunes, infecciosas y metabólicas. Encontrar formas de transportar anticuerpos terapéuticos a través de la barrera hematoencefálica (desde el torrente sanguíneo periférico hasta el sistema nervioso central) podría crear tratamientos eficaces que actúen en el cerebro.
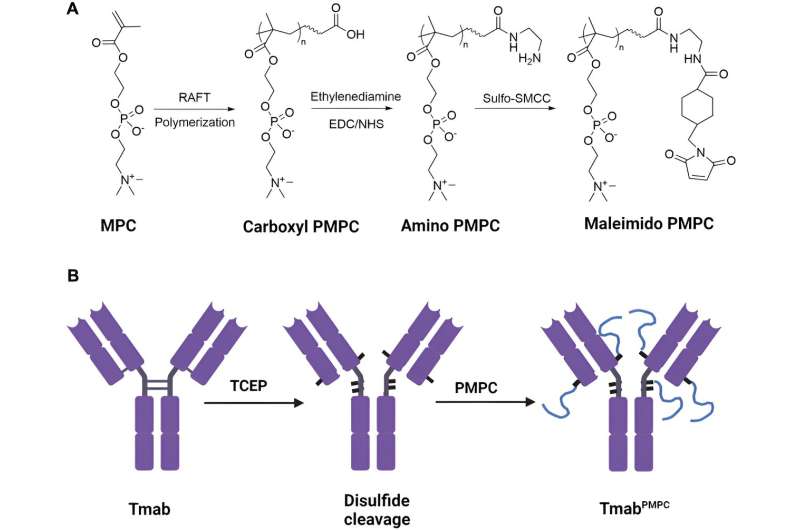
En un nuevo estudio publicado en la revista Frontiers in Cell and Developmental Biology , investigadores de la Universidad de Alabama en Birmingham informan que la adición dirigida al sitio de un polímero biodegradable aprobado por la FDA en las regiones bisagra y cercanas a la bisagra del anticuerpo terapéutico trastuzumab facilitó eficazmente la administración cerebral de este anticuerpo monoclonal humano IgG1. Trastuzumab se usa para tratar el cáncer de mama y varios otros tipos de cáncer.
El trabajo preliminar sobre esta nueva plataforma incluyó experimentos in vitro y con modelos de ratón. Los investigadores dicen que el sistema de administración aún debe optimizarse y probarse más a fondo, pero señalan que su metodología simple convierte la terapia con anticuerpos en una forma administrable al cerebro que mantiene la funcionalidad médica del anticuerpo.
"Las preocupaciones sobre la entrada al cerebro acechan el desarrollo de terapias con anticuerpos dirigidos a enfermedades cerebrales, impidiendo la traducción médica de los anticuerpos generados en laboratorio a las prácticas clínicas", dijo Masakazu Kamata, Ph.D., líder del estudio y profesor asociado. en el Departamento de Microbiología de la UAB. "En este contexto, esta sencilla metodología tiene un gran potencial para servir como plataforma no sólo para reutilizar las terapias de anticuerpos actuales, sino también para fomentar el diseño de nuevos anticuerpos para el tratamiento de enfermedades cerebrales".
El polímero biocompatible utilizado fue poli 2-metacriloiloxietilfosforilcolina, o PMPC, con longitudes de cadena de 50, 100 o 200 monómeros. Los investigadores ya habían descubierto que este polímero no inmunogénico, que la FDA aprobó como material de recubrimiento para dispositivos trasplantables, podría unirse a dos receptores en las células endoteliales microvasculares del cerebro que componen la barrera hematoencefálica, y esas células podrían luego mover el polímero. a través de la barrera hematoencefálica mediante transcitosis. La transcitosis es un transporte especializado mediante el cual la carga extracelular ingresa a la célula, se transporta a través del citoplasma hasta el otro lado de la célula y luego se libera.
Los investigadores de la UAB pudieron escindir cuatro enlaces disulfuro entre cadenas en la bisagra de trastuzumab IgG1 y en las regiones cercanas a la bisagra, creando grupos tiol. Luego, cada grupo tiol se conjugó con una cadena de PMPC para crear moléculas de trastuzumab con una de las tres longitudes de cadena, que denominaron Tmab-PMPC50, Tmab-PMPC100 y Tmab-PMPC200.
Cada uno de estos anticuerpos modificados aún mantenía la unión específica de trastuzumab a las células que expresan el antígeno HER2, el objetivo de trastuzumab. Tanto Tmab-PMPC50 como Tmab-PMPC100 se internalizaron en células HER2 positivas y promovieron la muerte celular dependiente de anticuerpos, que es la funcionalidad médica mediante la cual trastuzumab mata las células de cáncer de mama HER2+.
Luego, los investigadores demostraron que la conjugación PMPC de trastuzumab mejoraba la penetración de la barrera hematoencefálica a través de las células epiteliales de la barrera hematoencefálica a través de la vía de transcitosis. El Tmab-PMPC100 translocable fue el mejor en penetración eficiente de la barrera hematoencefálica y al mismo tiempo retuvo el reconocimiento del epítopo de trastuzumab, la capacidad del anticuerpo para unirse a su antígeno objetivo.
En un modelo de ratón, tanto Tmab-PMPC100 como Tmab-PMPC200 fueron cinco veces mejores en la penetración cerebral que el trastuzumab nativo. En experimentos preliminares in vitro y en modelos de ratón, el trastuzumab modificado con polímeros no indujo neurotoxicidad, no mostró efectos adversos en el hígado y no alteró la integridad de la barrera hematoencefálica.
"Esos hallazgos indican colectivamente que la conjugación de PMPC logra una administración cerebral efectiva de anticuerpos terapéuticos, como trastuzumab, sin inducción de efectos adversos, al menos en el hígado, la barrera hematoencefálica o el cerebro", afirmó Kamata.
Otros también han investigado formas de hacer que cargas como anticuerpos atraviesen la barrera hematoencefálica, anotaron los investigadores.
En el trabajo que condujo al estudio actual, los investigadores de la UAB habían demostrado que podían envolver varias cargas macromoleculares dentro de cubiertas de PMPC, y estas nanocápsulas demostraron una circulación sanguínea prolongada, una inmunogenicidad reducida y una mejor administración cerebral en ratones y primates no humanos.
Sin embargo, este sistema tenía desventajas. Las nanocápsulas requirieron la adición de ligandos dirigidos para llevarlos al objetivo de la enfermedad y reticulantes degradables que permitirían la liberación de la carga en ese sitio. Desafortunadamente, los microambientes asociados a enfermedades a menudo carecen de condiciones que puedan desencadenar la degradación de los reticulantes.
Otros investigadores que buscan romper la barrera hematoencefálica han investigado varios ligandos distintos de PMPC para estimular el transporte, como ligandos derivados de microbios y toxinas, o proteínas endógenas como las lipoproteínas. Por lo general, estos han tenido propiedades superficiales indeseables, como ser altamente inmunogénicos, altamente hidrófobos o cargados. PMPC no exhibe esos rasgos indeseables.
Los coautores de Kamata en el estudio, "Conjugación orientada al sitio de poli(2-metacriloiloxietilfosforilcolina) para una mejor administración cerebral de anticuerpos", son Jie Ren, Chloe E. Jepson, Charles J. Kuhlmann, Stella Uloma Azolibe y Madison T. Blucas, Departamento de Microbiología de la UAB; Sarah L. Nealy y Eugenia Kharlampieva, Departamento de Química de la UAB; Satoru Osuka, Departamento de Neurocirugía de la UAB; y Yoshiko Nagaoka-Kamata, Departamento de Patología de la UAB.
Más información: Jie Ren et al, Conjugación orientada al sitio de poli(2-metacriloiloxietilfosforilcolina) para mejorar la administración de anticuerpos al cerebro, Frontiers in Cell and Developmental Biology (2023). DOI:10.3389/fcell.2023.1214118
Proporcionado por la Universidad de Alabama en Birmingham