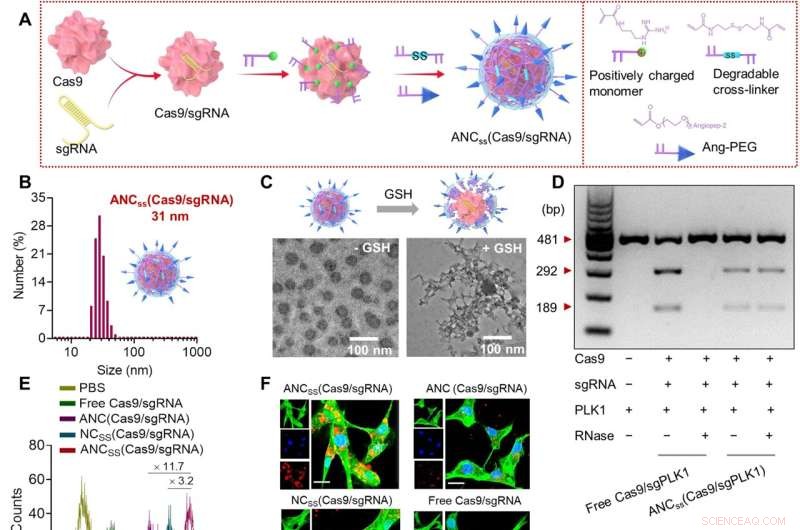
Fabricación, propiedades físicas y función celular de nanocápsulas Cas9/sgRNA. (A) Se usó la polimerización por radicales libres in situ para sintetizar nanocápsulas entrecruzadas con disulfuro que contenían Cas9/sgRNA y se funcionalizaron con el ligando dirigido a angiopep-2. (B) Distribución de tamaño de ANCSS (Cas9/sgRNA) nanocápsulas determinadas por dispersión de luz dinámica. (C) Imágenes TEM de ANCSS (Cas9/sgRNA) con o sin tratamiento con GSH. (D) Análisis de electroforesis en gel del ANCSS (Cas9/sgPLK1) o Cas9/sgPLK1 libre con o sin tratamiento con RNasa (1 mg/ml, 30 min). (E) Citometría de flujo de células U87MG después de 4 horas de incubación con ANCSS (Cas9/sgRNA) o controles. (F) Imágenes de microscopía de barrido láser confocal (CLSM) de células U87MG después de 4 horas de incubación con ANCSS (Cas9/sgRNA) o controles. Cas9 se etiquetó con Alexa Fluor 647 (AF647; rojo); el citoesqueleto se tiñó con Alexa Fluor 488 (verde) y los núcleos se tiñeron con Hoechst 33342 (azul). Para (E) y (F), la concentración de AF647-Cas9 fue de 20 nM. Barras de escala, 20 μm. (G) Eficiencia de edición de genes de luciferasa en células U87MG-Luc incubadas con ANCSS (Cas9/sgRNA) o controles durante 72 horas. Los datos se presentan como medias ± DE (n =5; *P <0,05, **P <0,01 y ***P <0,001). (H) Indels del gen PLK1 en células U87MG transfectadas con ANCSS (Cas9/sgPLK1) o controles durante 48 horas. (I) Esquema de la edición de genes en el núcleo. (J) Niveles de expresión de PLK1 en células U87MG después de 72 horas de incubación con ANCSS (Cas9/sgPLK1) o controles. (K) Ensayo de apoptosis de células U87MG después de 72 horas de incubación con ANCSS (Cas9/sgRNA) y otros controles. Para (G) a (K), la concentración de Cas9 fue de 20 nM. pb, pares de bases; PBS, solución salina tamponada con fosfato. Crédito:Avances científicos (2022). DOI:10.1126/sciadv.abm8011
Un equipo internacional de investigadores ha desarrollado una nanocápsula que es capaz de cruzar la barrera hematoencefálica (BBB) para transportar la herramienta de edición CRISPR-Cas9 para tratar un tumor cerebral. En su artículo publicado en la revista Science Advances, el grupo describe cómo crearon su cápsula y qué tan bien funcionó cuando se probó en ratones con glioblastoma.
Los glioblastomas son notoriamente difíciles de tratar. Los tumores aparecen en el cerebro y su crecimiento daña el tejido. Las opciones de tratamiento incluyen la extirpación quirúrgica, inyecciones directas de terapias destinadas a matar las células cancerosas o la inserción de virus CRISPR en el torrente sanguíneo. Cada una de estas opciones tiene una desventaja, desde tejido cerebral dañado hasta ineficacia debido a las dificultades con las terapias que cruzan la BBB. En este nuevo esfuerzo, los investigadores probaron un nuevo enfoque, utilizando una nanocápsula para llevar la herramienta de edición CRISPR-Cas9 al tumor cerebral, donde se dirige a un gen responsable del desarrollo de nuevas células, una cápsula que es capaz de cruzando la BBB.
La cubierta de la nanocápsula se creó utilizando un polímero reticulado de disulfuro que luego se aplicó con un péptido angiopep-2. El péptido se añadió para crear una carga superficial neutra para que no fuera atacado por la ribonucleasa. El caparazón era lo suficientemente grande como para contener un complejo Cas9, pero lo suficientemente pequeño (aproximadamente 30 nanómetros de longitud) para permitirle pasar a través de la BBB.
Los investigadores probaron su sistema de administración de nanocápsulas en modelos de ratones con glioblastoma. Cada uno recibió una sola inyección en la cola:algunos recibieron el sistema de administración de nanocápsulas recientemente desarrollado, mientras que otros recibieron un control. Los investigadores encontraron que los ratones que recibieron la nueva terapia tuvieron un tiempo de supervivencia promedio de 68 días en comparación con los 24 días del grupo de control. También encontraron una tasa de mutación genética no deseada de menos del 0,5 % en otro tejido cerebral.
Los investigadores sugieren que su trabajo representa un nuevo paso hacia enfoques no invasivos y no virales para tratar los glioblastomas, aunque reconocen que se necesita mucho más trabajo antes de poder determinar si el mismo enfoque será seguro y efectivo en humanos.
© 2022 Red Ciencia X Pequeñas cápsulas ofrecen una alternativa a la administración viral de la terapia génica