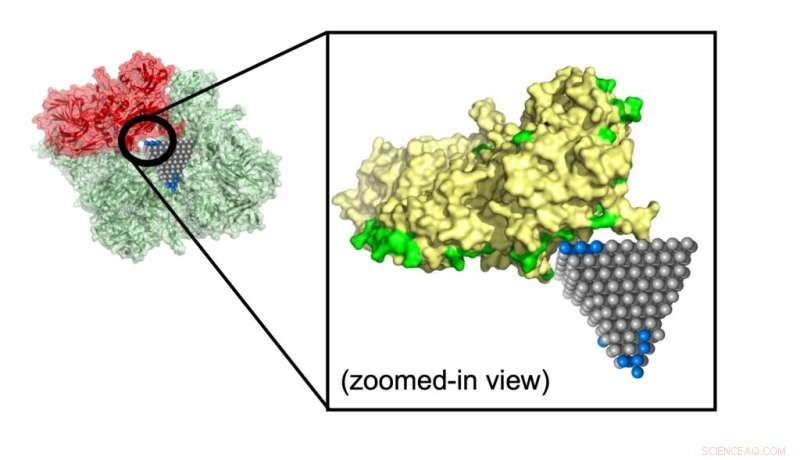
El modelo predijo cómo una nanopirámide de óxido de zinc interrumpe una proteína que contribuye al metabolismo en MRSA (Staphylococcus aureus resistente a la meticilina), una cepa común que causa infecciones resistentes a los antibióticos. Crédito:Minjeong Cha y Emine Sumeyra Turali Emre, Kotov Lab
Con las infecciones resistentes a los antibióticos en aumento y un virus pandémico en constante transformación, es fácil ver por qué los investigadores quieren poder diseñar nanopartículas diseñadas que puedan acabar con estas infecciones.
Un nuevo modelo de aprendizaje automático que predice interacciones entre nanopartículas y proteínas, desarrollado en la Universidad de Michigan, nos acerca un paso más a esa realidad.
"Hemos reinventado las nanopartículas para que sean más que meros vehículos de administración de fármacos. Las consideramos fármacos activos en sí mismos", dijo J. Scott VanEpps, profesor asistente de medicina de emergencia y autor del estudio en Nature Computational ciencia .
El descubrimiento de fármacos es un proceso lento e impredecible, por lo que tantos antibióticos son variaciones de un fármaco anterior. A los desarrolladores de fármacos les gustaría diseñar medicamentos que puedan atacar bacterias y virus de la forma que elijan, aprovechando los mecanismos de "cerradura y llave" que dominan las interacciones entre las moléculas biológicas. Pero no estaba claro cómo pasar de la idea abstracta de usar nanopartículas para interrumpir las infecciones a la implementación práctica del concepto.
"Al aplicar métodos matemáticos a las interacciones proteína-proteína, hemos simplificado el diseño de nanopartículas que imitan una de las proteínas en estos pares", dijo Nicholas Kotov, profesor distinguido de Ciencias Químicas e Ingeniería de la Universidad Irving Langmuir y autor correspondiente del estudio. .
"Las nanopartículas son más estables que las biomoléculas y pueden conducir a clases completamente nuevas de agentes antibacterianos y antivirales".
El nuevo algoritmo de aprendizaje automático compara las nanopartículas con las proteínas utilizando tres formas diferentes de describirlas. Si bien la primera era una descripción química convencional, las dos relacionadas con la estructura resultaron ser las más importantes para hacer predicciones sobre si una nanopartícula sería una combinación segura con una proteína específica.
Entre ellas, estas dos descripciones estructurales capturaron la superficie compleja de la proteína y cómo podría reconfigurarse para permitir ajustes de bloqueo y llave. Esto incluye bolsillos en los que podría caber una nanopartícula, junto con el tamaño que debería tener dicha nanopartícula. Las descripciones también incluyeron la quiralidad, un giro en el sentido de las agujas del reloj o en el sentido contrario a las agujas del reloj que es importante para predecir cómo se unirán una proteína y una nanopartícula.
"Hay muchas proteínas fuera y dentro de las bacterias a las que podemos apuntar. Podemos usar este modelo como una primera evaluación para descubrir qué nanopartículas se unirán con qué proteínas", dijo Emine Sumeyra Turali Emre, investigadora postdoctoral en ingeniería química y co-primera autor del artículo, junto con Minjeong Cha, Ph.D. estudiante de ciencia e ingeniería de materiales.
Emre y Cha explicaron que los investigadores podrían hacer un seguimiento de las coincidencias identificadas por su algoritmo con simulaciones y experimentos más detallados. Una de esas coincidencias podría detener la propagación de MRSA, una cepa común resistente a los antibióticos, utilizando nanopirámides de óxido de zinc que bloquean las enzimas metabólicas de la bacteria.
"Los algoritmos de aprendizaje automático como el nuestro proporcionarán una herramienta de diseño para nanopartículas que se pueden usar en muchos procesos biológicos. La inhibición del virus que causa la COVID-19 es un buen ejemplo", dijo Cha. "Podemos usar este algoritmo para diseñar eficientemente nanopartículas que tengan actividad antiviral de amplio espectro contra todas las variantes".
Este avance fue posible gracias a la Iniciativa Blue Sky de la Facultad de Ingeniería de la U-M, que brindó apoyo al equipo interdisciplinario que llevó a cabo la exploración fundamental de si un enfoque de aprendizaje automático podría ser efectivo cuando los datos sobre la actividad biológica de las nanopartículas son tan escasos.
"El núcleo de la idea de Blue Sky es exactamente lo que cubre este trabajo:encontrar una manera de representar proteínas y nanopartículas en un enfoque unificado para comprender y diseñar nuevas clases de medicamentos que tengan múltiples formas de actuar contra las bacterias", dijo Angela Violi, una Arthur F. Thurnau Profesor, profesor de ingeniería mecánica y líder del proyecto Blue Sky de nanobiótica.
Los colaboradores de la Universidad de California en Los Ángeles también contribuyeron al algoritmo de aprendizaje automático. Nueva herramienta permite un modelado sin precedentes de nanopartículas magnéticas