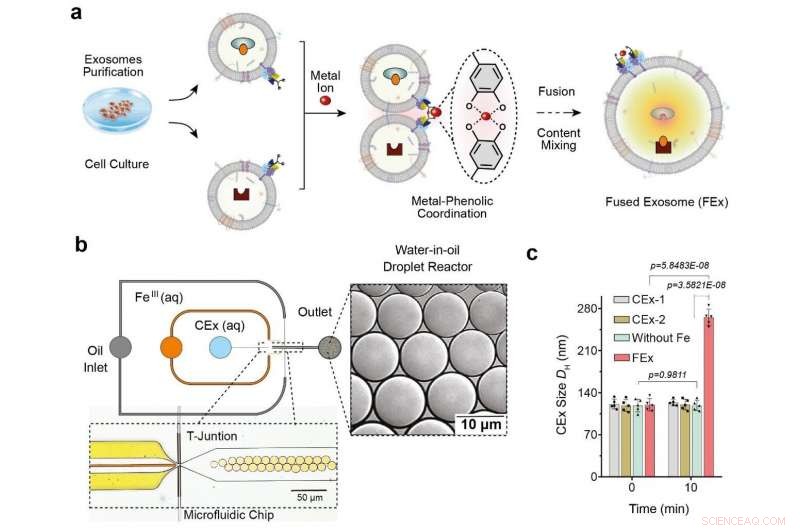
(a) El ion Fe3 + desencadena la fusión de la membrana en exosomas adaptados con catecol (CEx). La formación de un complejo de metal-catecol acerca a los exosomas y permite la fusión. Luego, los diferentes reactivos en cada exosoma se encapsulan juntos, promoviendo reacciones de mezcla y activación dentro de los exosomas fusionados (FEx). (b) El dispositivo de microfluidos diseñado para generar reactores de gotas de agua en aceite en la unión de enfoque de flujo. Las dos fases acuosas (CEx y sal metálica) se encuentran y se suministran a la corriente de aceite (1% de tensioactivo PFPE-PEG en FC-40) para romper el líquido en gotitas. (c) Tamaño medio de los exosomas no fusionados (CEx-1:121 ± 8 nm, CEx-2:123 ± 5 nm) y exosomas fusionados (FEx:265 ± 14 nm). Crédito:Instituto de Ciencias Básicas
Las células tienen pequeños compartimentos conocidos como orgánulos que realizan reacciones bioquímicas complejas. Estos compartimentos tienen múltiples enzimas que trabajan juntas para ejecutar importantes funciones celulares. Investigadores del Center for Soft and Living Matter dentro del Institute for Basic Science (IBS, Corea del Sur) han imitado con éxito estos compartimentos espaciales a nanoescala para crear "mitocondrias artificiales". El estudio se publica en Catálisis de la naturaleza como artículo de portada. Los investigadores afirman que la tecnología se puede utilizar para construir orgánulos artificiales que puedan suministrar ATP u otras moléculas útiles a las células en tejidos dañados o enfermos.
Esto se logró mediante la reprogramación de exosomas, que son pequeñas vesículas (diámetro ~ 120 nm) que las células utilizan para la señalización intercelular. Los investigadores llevaron a cabo los experimentos utilizando reactores de gotas de microfluidos, que generó pequeñas gotas de tamaño similar al de las células típicas. (diámetro ~ 10 μm) Los investigadores primero apuntaron a facilitar la fusión controlada de estos exosomas dentro de las gotitas al tiempo que prevenían fusiones no deseadas.
Lo lograron adaptando las superficies del exosoma con moléculas llamadas catecol, que es un agente quelante que forma complejos con iones metálicos. Esto, a su vez, se hizo uniendo el catecol a los anticuerpos que se dirigen a marcadores celulares específicos, como CD9. La propiedad de formación de complejos del catecol les permite impulsar fusiones entre exosomas cuando se mezclan con iones metálicos como Fe. 3+ . La fusión de la membrana ocurre cuando los catecoles en las superficies se unen al hierro y acercan las vesículas unas a otras.
Los investigadores primero probaron la efectividad de este sistema cargando un tipo de exosomas con calceína-Co 2+ y otro con EDTA. Cuando las dos vesículas se fusionan y el contenido se mezcla, EDTA agarra el Co 2+ lejos de la calceína, que luego permite que este último tenga fluorescencia. El equipo se dio cuenta de que tenían éxito al detectar la señal de fluorescencia, y la fusión se confirmó además duplicando el diámetro del exosoma medido.
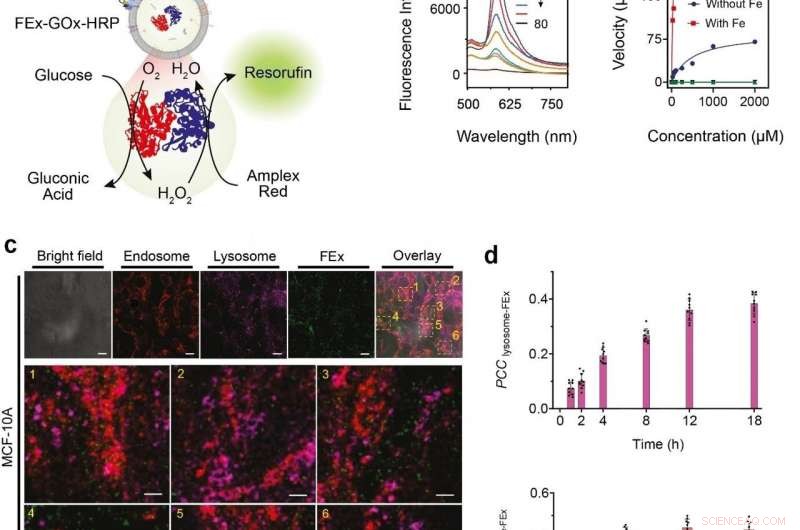
(a) Representación esquemática de un GOx / HRP CEx de dos enzimas que se fusiona en FEx. La reacción catalítica se inició agregando glucosa, generando H2O2 por oxidación aeróbica, que luego se utilizó para oxidar Amplex Red para generar resorufina. (b) Espectros de fluorescencia representativos de resorufina generados por biocatálisis en exosomas fusionados (FEx-GOx-HRP) en diferentes puntos de tiempo. Tasa de reacción del nanoreactor frente a la concentración de glucosa para calcular las constantes cinéticas ajustando la ecuación de Michaelis-Menten. (c) Estabilidad e integridad de FEx-GOx-HRP después de la integración celular después de 48 h. Endosomas (EEA1, rojo) lisosomas (LAMP1, magenta), y FEx (verde) se muestran. (d) Gráfico de los valores del coeficiente de correlación de Pearson (PCCLysosome-FEx) a lo largo del tiempo para la fluorescencia magenta (lisosoma) y verde (FEx), y para fluorescencia roja (endosoma) y verde (FEx). Crédito:Instituto de Ciencias Básicas
Estos exosomas personalizados fueron luego precargados con diferentes reactivos y enzimas, lo que los convirtió en nano fábricas biomiméticas. Esto les permite producir biomoléculas de alto valor realizando las transformaciones biocatalíticas deseadas de una manera espacialmente confinada que no es posible usando tubos de ensayo de laboratorio convencionales. El equipo demostró esta función de cascada biocatalítica multienzimática al encapsular la glucosa oxidasa (GOx) y la peroxidasa de rábano picante (HRP) dentro de los exosomas. El GOx primero convierte la glucosa en ácido glucónico y peróxido de hidrógeno. El HRP a su vez utiliza el peróxido de hidrógeno generado en la primera reacción para oxidar Amplex Red a un producto fluorescente, resorufina. Los investigadores incluso pudieron dar un paso más al agregar una tercera enzima, galactosidasa que convierte la lactosa en glucosa, en la mezcla.
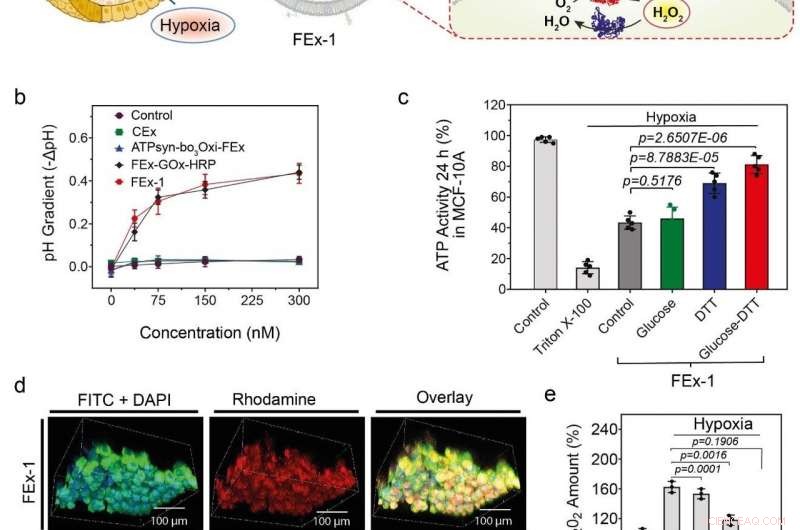
(a) Montaje de orgánulos artificiales para la generación de energía. La ATP sintasa se reconstituyó en CEx-GOx y la bo3 oxidasa se reconstituyó en CEx-HRP. Los dos CEx se fusionaron y pudieron penetrar profundamente en los esferoides. (b) Disminución del pH (-ΔpH) frente a las concentraciones de glucosa para diferentes exosomas. Los exosomas fusionados muestran un mayor grado de disminución del pH. (c) Cambios en la producción de ATP después de la absorción de FEx-1 en diferentes condiciones. (d) Los orgánulos artificiales pudieron penetrar profundamente en el esferoide. La fila superior muestra FEx-1 (etiquetado en rojo con rodamina B), mientras que la fila inferior muestra la enzima HRP libre dentro de los esferoides. (e) Los niveles generales de ROS disminuyeron al someter FEx-1 a glucosa y DTT. Crédito:Instituto de Ciencias Básicas
Próximo, los investigadores querían saber exactamente qué tan bien estos mini reactores pueden ser absorbidos e internalizados por las células. Las células derivadas de tejidos mamarios humanos se alimentaron con nanoreactores de exosomas fusionados, y su internalización durante las siguientes 48 horas se observó utilizando varios marcadores y un microscopio de barrido láser confocal (CLSM). Se encontró que las células podían captar estos exosomas personalizados principalmente a través de endocitosis, junto con muchos otros mecanismos. Además, probaron el sistema de dos enzimas GOx-HRP en las células, y se descubrió que los exosomas fusionados podían fabricar con éxito productos fluorescentes incluso estando dentro de las células.
Armado con este conocimiento, el equipo buscó crear mitocondrias artificiales funcionales que sean capaces de producir energía dentro de las células. Lograr esto, ATP sintasa y bo 3 oxidasa se reconstituyeron en los exosomas anteriores que contenían GOx y HRP, respectivamente. Estos exosomas, a su vez, se fusionaron para crear nanoreactores que pueden producir ATP utilizando glucosa y ditiotreitol (DTT). Se descubrió que los exosomas fusionados eran capaces de penetrar profundamente en la parte central de un tejido esferoide sólido y producir ATP en su entorno hipóxico. Las actividades de estos orgánulos simples fueron acompañadas por una marcada reducción de la generación de especies reactivas de oxígeno (ROS). A diferencia de, las enzimas libres no pudieron penetrar dentro de estos esferoides de células apretados.
"Tomados en conjunto, Nuestros resultados destacan el potencial de estos exosomas como nanoreactores en la regulación de la actividad metabólica de las células dentro de los esferoides. y en la atenuación del daño celular debido a la hipoxia, "señala CHO Yoon-Kyoung, el autor correspondiente del estudio. Se espera que una mayor investigación sobre estos orgánulos artificiales presente un nuevo paradigma en varios campos, como el diagnóstico y el tratamiento de enfermedades, biotecnología, medicamento, y el medio ambiente.