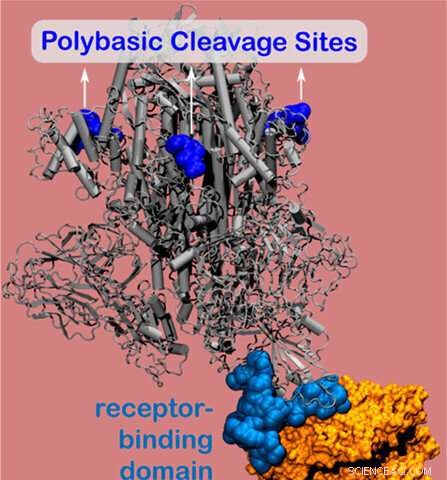
Modelo informático que muestra sitios de escisión poli básica en la proteína de pico del nuevo coronavirus. Crédito:Universidad Northwestern.
Los investigadores de la Universidad de Northwestern han descubierto una nueva vulnerabilidad en la infame proteína de pico del nuevo coronavirus, iluminando una relativamente simple, posible vía de tratamiento.
La proteína de pico contiene el sitio de unión del virus, que se adhiere a las células huésped y permite que el virus ingrese e infecte el cuerpo. Usando simulaciones a nivel nanométrico, los investigadores descubrieron un sitio cargado positivamente (conocido como sitio de escisión polibásico) ubicado a 10 nanómetros del sitio de unión real en la proteína de pico. El sitio cargado positivamente permite una fuerte unión entre la proteína del virus y los receptores de células humanas cargados negativamente.
Aprovechando este descubrimiento, los investigadores diseñaron una molécula cargada negativamente para unirse al sitio de escisión cargado positivamente. El bloqueo de este sitio inhibe que el virus se una a la célula huésped.
"Nuestro trabajo indica que bloquear este sitio de escisión puede actuar como un tratamiento profiláctico viable que disminuye la capacidad del virus para infectar a los humanos, "dijo Monica Olvera de la Cruz de Northwestern, quien dirigió el trabajo. "Nuestros resultados explican los estudios experimentales que muestran que las mutaciones de la proteína pico del SARS-CoV-2 afectaron la transmisibilidad del virus".
La investigación fue publicada en línea la semana pasada en la revista. ACS Nano .
Olvera de la Cruz es la Profesora Lawyer Taylor de Ciencia e Ingeniería de Materiales en la Escuela de Ingeniería McCormick de Northwestern. Baofu Qiao, profesor asistente de investigación en el grupo de investigación de Olvera de la Cruz, es el primer autor del artículo.
Compuesto por aminoácidos, Los sitios de escisión polibásica del SARS-CoV-2 han permanecido esquivos desde que comenzó el brote de COVID-19. Pero investigaciones anteriores indican que estos sitios misteriosos son esenciales para la virulencia y la transmisión. Olvera de la Cruz y Qiao descubrieron que el sitio de escisión polibásico se encuentra a 10 nanómetros de los receptores de células humanas, un hallazgo que proporcionó información inesperada.
"No esperábamos ver interacciones electrostáticas a 10 nanómetros, ", Dijo Qiao." En condiciones fisiológicas, todas las interacciones electrostáticas ya no ocurren a distancias superiores a 1 nanómetro ".
"La función del sitio de escisión polibásica sigue siendo difícil de alcanzar, "Dijo Olvera de la Cruz." Sin embargo, parece estar escindido por una enzima (furina) que abunda en los pulmones, lo que sugiere que el sitio de escisión es crucial para la entrada del virus en las células humanas ".
Con esta nueva información, A continuación, Olvera de la Cruz y Qiao planean trabajar con químicos y farmacólogos de Northwestern para diseñar un nuevo fármaco que pueda unirse a la proteína de pico.