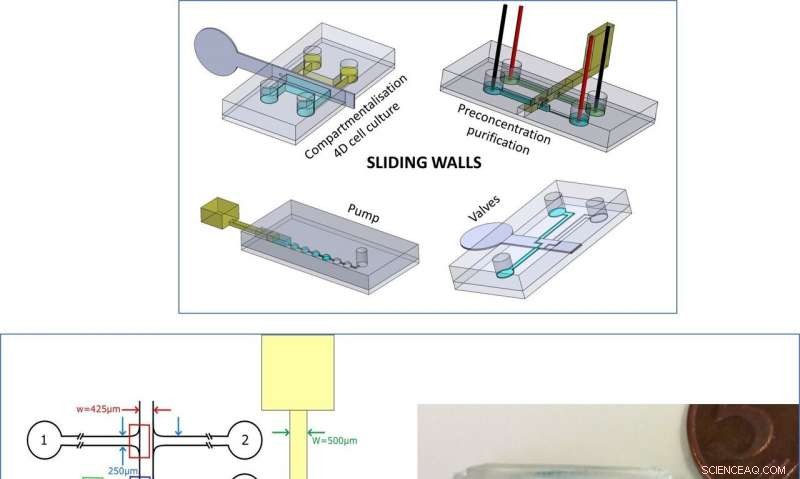
Arriba:Resumen de la nueva tecnología. Izquierda:Diseño del microchip y pared deslizante para la preconcentración del ADN. Derecha:imagen del microchip y la pared deslizante para experimentos de compartimentación. Se han agregado tintes azules y amarillos para visualización. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0125-7
Un equipo de investigación desarrolló recientemente "paredes deslizantes" como una nueva técnica para el control de fluidos en dispositivos de microfluidos, permitiendo que las paredes semirrígidas o rígidas se deslicen dentro de un chip de microfluidos. En un nuevo informe ahora en Naturaleza:microsistemas y nanoingeniería , Bastien Venzac y un equipo de científicos del Instituto Curie y de la Universidad de la Sorbona en París, Francia, diseñó varias funciones fluídicas utilizando geometría de pared deslizante. El dispositivo contenía válvulas de encendido / apagado para bloquear o reconfigurar canales según la geometría de la pared. La configuración contenía una membrana a base de hidrogel para concentrar, purificar y transportar biomoléculas de un canal a otro. La técnica es compatible con los métodos de litografía blanda para una fácil implementación basada en flujos de trabajo de fabricación típicos en chips de polidimetilsiloxano (PDMS). El nuevo método abre una ruta a una variedad de aplicaciones de microfluidos, formando simple, Dispositivos manuales para aplicaciones en el punto de atención en laboratorios biológicos.
Los sistemas verdaderamente reconfigurables son el sueño de un ingeniero de microfluidos, donde la remodelación describe sistemas inteligentes construidos en unidades modulares y ensamblados para una rápida reorganización entre experimentos. Para la mayoría de los sistemas de microfluidos, sin embargo, la red de canales permanece fija durante la microfabricación y no se puede reestructurar de forma personalizada durante el experimento. Los ingenieros también solo pueden realizar cambios en el bombeo, valvular o utilizar fuerzas externas de electricidad y campos magnéticos. Para cumplir con los límites o desafíos existentes de la producción de microfluidos, Venzac y col. propuso un nuevo concepto de actuación microfluídica conocido como "paredes deslizantes". El método es compatible con la fabricación de litografía blanda pero no requiere equipo externo. Se puede operar manualmente y se puede incluir en un solo componente del dispositivo.
Venzac y col. desarrolló paredes deslizantes utilizando varios métodos de fabricación para diseñarlas dentro de canales abiertos de chips de polidimetilsiloxano (PDMS). El proceso de actuación les permitió abrir o cerrar reversiblemente un canal de bombeo de fluidos, luego reoriente los flujos para reconfigurar una red de microfluidos a voluntad. El equipo describió el principio del método y demostró funciones simples, incluida la formación de una losa de hidrogel para acomodar cuatro dimensiones (4-D), cultivo celular controlado, seguido de preconcentración de ADN electrocinético basado en membranas en compartimentos microfluídicos. Implementaron la tecnología a bajo costo para la creación rápida de prototipos y controlaron manualmente las paredes deslizantes para simplificar, el equipo también podría automatizar completamente las paredes utilizando motores o actuadores controlados por computadora. La nueva caja de herramientas está bien adaptada para aplicaciones con dimensiones de canales de microfluidos superiores a 100 µm y solo requieren pocos elementos de actuación.
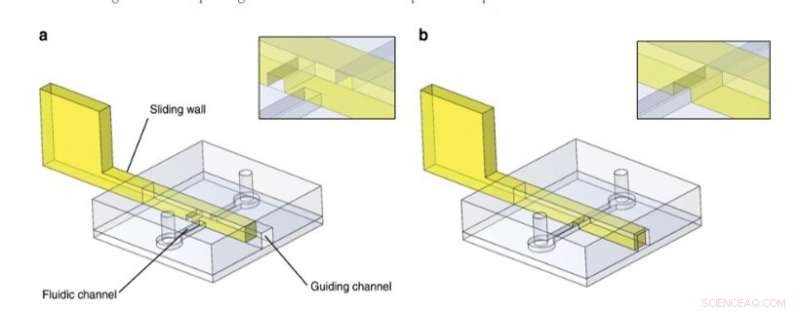
Principio de pared corrediza. Las estructuras de PDMS contienen un canal de guía y un canal fluídico y se unieron a una superficie plana de PDMS. En este ejemplo, se insertó una pared deslizante con un canal grabado después de la fabricación de la viruta dentro del canal de guía. El canal fluídico estaba bloqueado o libre. Los detalles de la intersección de la pared deslizante / canal fluídico se proporcionan en los insertos. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0125-7
Para el principio de diseño general, Los investigadores insertaron una estructura rígida / semirrígida en un canal de guía en el chip de microfluidos PDMS y utilizaron una variedad de materiales para desarrollar paredes deslizantes que incluyen (1) películas de acero inoxidable, (2) fotocurable resistente fotopolimerizado en moldes PDMS, y (3) resina fotocurable moldeada usando impresión estereolitográfica 3-D. Seleccionaron las técnicas de ingeniería para adaptarse al experimento de acuerdo con sus propiedades intrínsecas y evitaron el pandeo o rotura de la pared durante el accionamiento controlando la rigidez del material, prefiriendo el acero inoxidable para la mayoría de las paredes deslizantes delgadas. Para las paredes deslizantes más grandes, utilizaron estereolitografía convencional y utilizaron micro-fresado en acero inoxidable para incluir pequeñas características en una pared deslizante.
Como prueba de concepto inicial, Venzac y col. preparó dos tipos de válvulas:una válvula de encendido / apagado y una válvula de interruptor metálico con una entrada y dos salidas. Las válvulas deslizantes son principalmente interesantes debido a su practicidad en dispositivos de órgano en chip y construcciones de cultivo celular. Los investigadores también mostraron el uso de paredes deslizantes como jeringas en chip para bombear fluidos manualmente y no observaron fugas de líquido durante el empuje o la aspiración de aire en los experimentos. Las paredes corredizas fueron ingeniosas para la construcción de cámaras grandes:el equipo agregó dos ranuras estrechas en el techo y el piso de la cámara para guiar una pared corrediza vertical de acero inoxidable y regular la comunicación entre los compartimentos.
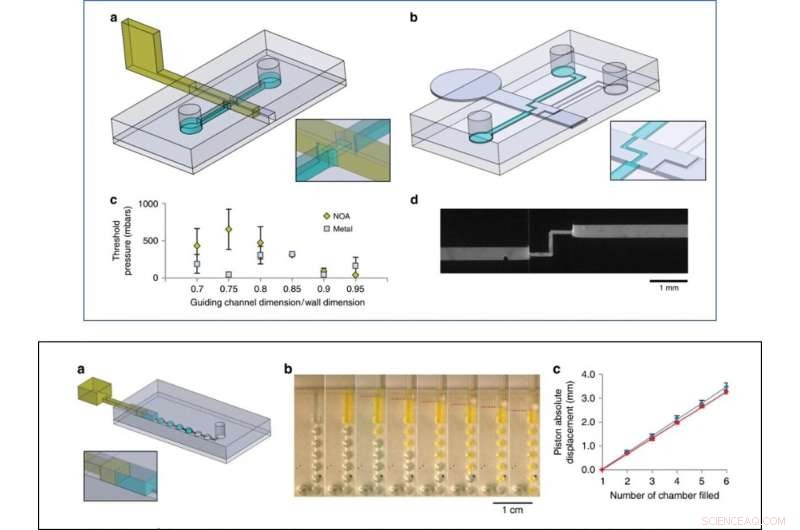
ARRIBA:Experimentos de válvulas. a Diseño del chip y la pared deslizante fotocurable a base de resistencia para el experimento de la válvula on-off. b Diseño del chip y la pared deslizante metálica para el experimento de la válvula de conmutación. c Presión máxima soportada por paredes de base resistiva (serie amarilla) y de base metálica (serie gris) para diferentes relaciones entre el canal de guía y las alturas y anchos de las paredes deslizantes (tres experimentos por condición). d Imagen fluorescente de la válvula de conmutación con agua cargada de fluoresceína fluyendo a través del camino abierto (13 µl / s). INFERIOR:Experimento de bombeo. un diseño de chip, b Imágenes secuenciales del bombeo de agua cargada de fluoresceína a través de cámaras de 1 µl. La posición del pistón se indica con líneas rojas discontinuas. c Desplazamiento de líquido versus desplazamiento absoluto del pistón (el origen del pistón se estableció al inicio del llenado de la primera cámara), para empujar (azul) y luego tirar (rojo), promediado sobre cuatro dispositivos diferentes. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0125-7
Finalmente, el equipo llevó a cabo pruebas de biofuncionalización utilizando el nuevo dispositivo y observó el cultivo celular 4-D y la migración celular. En este experimento, cargaron una solución de colágeno fluorescente en la mitad derecha de la cámara, llenó la segunda mitad con tampón y mezcló los dos para crear una losa de hidrogel. Estos hidrogeles son un requisito importante para desarrollar compartimentos de órgano en chip en 3D. Para probar su función biológica, Venzac y col. estudió la migración celular con células dendríticas (células inmunitarias) cargadas en la solución de colágeno dentro de una cámara. El equipo llenó el segundo compartimento con una solución de quimiocinas y retiró la pared deslizante de acero inoxidable para crear una interfaz recta que permita que el quimioatrayente se difunda sobre la placa de colágeno para que las células dendríticas migren a la interfaz gel / solución. formando un cultivo celular 4-D.
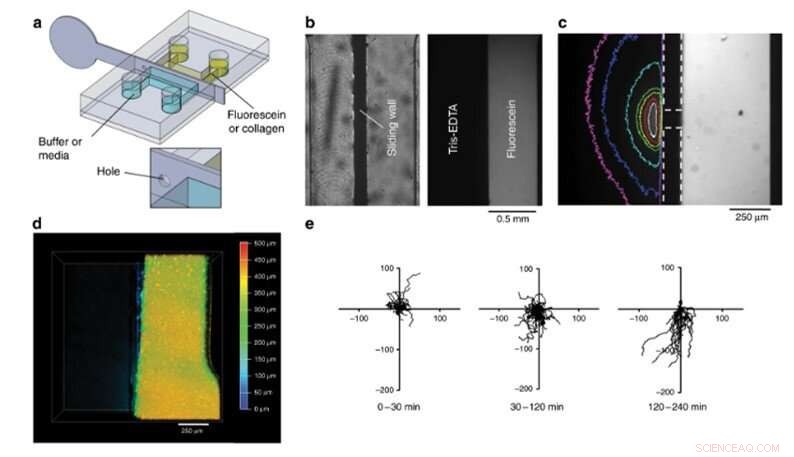
Experimentos de compartimentación. (a) Diseño del chip y muro deslizante metálico. (b) Imágenes de vista superior de una prueba de sellado. Izquierda:imagen brillante de la cámara. Derecha:imagen fluorescente de la cámara a las 8 h. (c) Gradiente de fluoresceína en el compartimento de tampón Tris-EDTA después de la colocación de un orificio de 200 µm en la pared deslizante dentro de la cámara. Los límites de las paredes corredizas y los orificios se indican con líneas de puntos. Las líneas de color corresponden a la superficie de la imagen con una intensidad superior al 12% del valor máximo (blanco:1 s, rojo:4 s, amarillo:9 s, verde:14 s, cian:50 s, azul:110 s, magenta:170 s después del desplazamiento de la pared). (d) Vista superior, imagen confocal codificada en profundidad de un fluorescente, losa de colágeno gelificado a la derecha, la mitad del fondo de la cámara después de retirar la pared deslizante. (e) Las trayectorias de las células dendríticas dentro de la placa de colágeno antes de la remoción de la pared deslizante (0-30 min) y después de la remoción de la pared deslizante (30-240 min) se descomponen en dos períodos. El primero no mostró migración preferencial (30-120 min), mientras que las células son atraídas al compartimento de quimiocinas de 120 a 240 min. Los ejes están en micrómetros, y el eje vertical apunta en dirección opuesta al compartimento de quimiocinas. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0125-7
También preconcentran electrocinéticamente macromoléculas de ADN, controló su transporte y liberación en la nueva configuración. Para lograr esto, el equipo utilizó una membrana de hidrogel móvil y reconfigurable en los sistemas de microfluidos y diseñó una pared deslizante con una ventana integrada mediante impresión 3D de alta resolución. Aplicaron un campo eléctrico constante en los canales para permitir la migración electroforética de ADN marcado con una etiqueta fluorescente en solución tampón. El tamaño de los poros de hidrogel impidió la migración del ADN, haciendo que se preconcentren en la membrana. Los científicos indujeron el flujo libre de ADN preconcentrado en la configuración, para transportar muestras de un canal a otro, como una ruta nueva y sencilla para la preparación y el análisis de muestras.
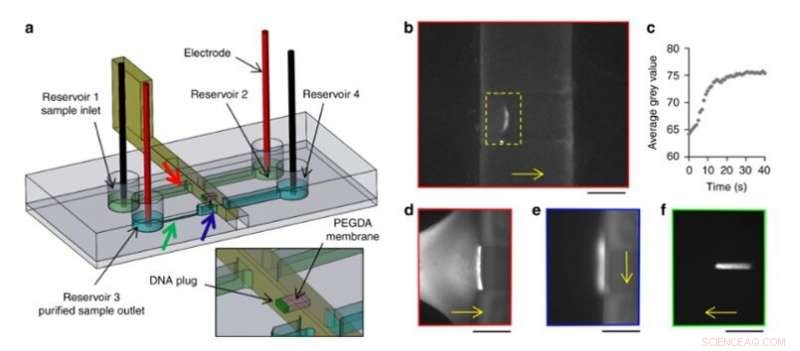
Experimento de preconcentración y purificación de ADN. (a) Diseño del chip y muro deslizante. Se fotopolimerizó una membrana PEGDA (rosa) en la ventana de una pared deslizante. Las flechas de colores indican la ubicación de las siguientes imágenes con el borde de color correspondiente. (b) Preconcentración por electroforesis de 100 pg de Lambda-DNA contra la membrana PEGDA en una pared deslizante impresa en 3D. (c) Evolución en el tiempo del valor medio de gris dentro del rectángulo amarillo de b). (d) Imágenes fluorescentes de ADN durante la preconcentración contra la membrana PEGDA, (e) después del desplazamiento al segundo canal y (f) liberación electroforética. Barras de escala:250 µm. Las direcciones de migración o desplazamiento del ADN se indican mediante flechas amarillas. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0125-7
De este modo, Bastien Venzac y sus colegas desarrollaron una nueva caja de herramientas para innovar el uso de microfluidos convencionales. Las paredes deslizantes tenían características adicionales como microcanales o ventanas con geles cargados y soluciones para aplicaciones potenciales más allá de las válvulas convencionales en chip. Notablemente, lograron el cultivo de células 4-D y la preconcentración de ADN utilizando la configuración de una sola pared deslizante. Los científicos visualizan la técnica en amplias aplicaciones para entornos biomédicos de bajo costo y baja tecnología.
© 2020 Science X Network