Un nuevo método de alta resolución desarrollado por un equipo internacional de científicos que incluye a Robert Tampé y Ralph Wieneke de la Universidad Goethe de Frankfurt ahora permite por primera vez la identificación y cuantificación precisas de las interacciones de un receptor con dos ligandos simultáneamente. Crédito:GU
Los procesos de señalización en los organismos se rigen por interacciones extracelulares e intracelulares específicas e involucran cientos de diferentes receptores funcionalmente muy versátiles situados en las membranas celulares. Para los científicos que desean comprender los procesos de señalización, la situación se vuelve más compleja porque los receptores no solo están distribuidos de manera desigual y, a menudo, pueden unirse a más de un ligando, sino también porque el mismo tipo de receptor puede unirse a un ligando con fuerza. débilmente o no todos. Se necesitan con urgencia nuevos métodos que permitan cuantificaciones precisas de interacciones tan complejas.
Un nuevo método de alta resolución desarrollado por un equipo internacional de científicos que incluye a Robert Tampé y Ralph Wieneke de la Universidad Goethe de Frankfurt ahora permite por primera vez la identificación y cuantificación precisas de las interacciones de un receptor con dos ligandos simultáneamente. El nuevo método ha sido publicado en la última edición de la revista. Comunicaciones de la naturaleza .
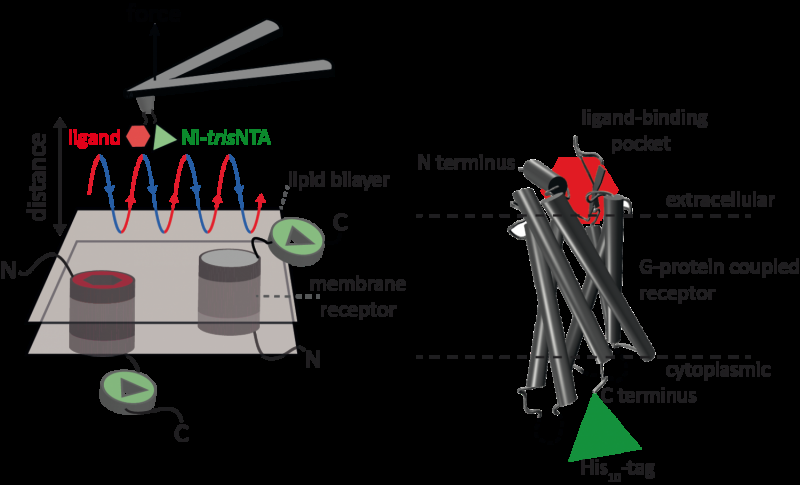
La microscopía de fuerza atómica (AFM) es una técnica poderosa para la caracterización a nanoescala de superficies. Utiliza un voladizo con una punta extremadamente fina. La microscopía de fuerza atómica basada en curvas de fuerza-distancia (AFM basado en FD) combina imágenes de alta resolución y espectroscopía de fuerza de una sola molécula. En estudios que utilizan muestras biológicas, la punta AFM se acerca y se retrae de la muestra para cada píxel. Los métodos AFM basados en FD utilizan diferentes recubrimientos de la punta AFM como caja de herramientas y dichos métodos han logrado un progreso impresionante en los últimos años. Para la detección de sitios de unión específicos, el AFM basado en FD requiere la unión de un ligando a la punta del AFM. Mientras se contornean complejos de proteínas en una membrana, tales puntas de AFM funcionalizadas pueden medir las interacciones del ligando unido a la proteína. No había sido posible obtener imágenes de receptores de membrana única y detectar simultáneamente sus interacciones con más de un ligando, pero el nuevo método ha superado este obstáculo.
Para su prueba de principio, los científicos utilizaron el receptor 1 activado por proteasa humana (PAR1), uno de la gran familia de receptores de membrana acoplados a proteína G. Los GPCR median la mayoría de las respuestas celulares a hormonas y neurotransmisores, además de ser responsable de la visión, olfato y gusto. Los GPCR pueden coexistir en diferentes estados funcionales en la membrana celular y pueden unirse a varios ligandos con diferente fuerza o afinidad. El GPCR PAR1 es activado por la proteasa de coagulación trombina que desencadena cascadas de señalización para iniciar respuestas celulares que ayudan a orquestar la hemostasia. trombosis, inflamación y posiblemente también reparación de tejidos. Con la ayuda de su nuevo método AFM basado en FD, se pudieron obtener imágenes de PAR1 humana en proteoliposomas mientras se detectaban simultáneamente interacciones extracelulares e intracelulares de PAR1 con dos ligandos. La química de superficie y el método nanoscópico desarrollados son aplicables a una variedad de sistemas biológicos in vitro e in vivo.