
a) Microestructura de armazones de colágeno cargados con células examinados bajo TEM. Las células están rodeadas por la matriz de colágeno. Las fibrillas de colágeno no mostraron una dirección preferida alrededor de las células en condiciones de control, b) Los IONP se pueden identificar en la matriz de colágeno yc) cerca de las membranas celulares. Después de 14 días, las células sintetizaron una nueva matriz, d) sin SMF ye) con SMF. Ambas condiciones llevaron a una nueva síntesis de matriz después de 14 días, sin una diferencia significativa. Crédito: Informes científicos , doi:10.1038 / s41598-018-33455-2.
Los mecanismos celulares y moleculares de la regeneración ósea basada en estimulación magnética requieren una mayor comprensión en la actualidad. Para evaluar el fenómeno en el laboratorio, Recientemente se desarrolló un modelo de colágeno nativo tridimensional (3-D) mediante compresión plástica para producir un modelo celular, estructura de colágeno densa y mecánicamente fuerte. Para producir modelos cargados de células en el estudio, Zhiyu Yuan y sus colegas incorporaron células de osteoblastos (línea celular MG-63) y nanopartículas magnéticas de óxido de hierro (IONP) en los geles de colágeno. Usando la impresión 3-D, Se diseñó y fabricó un biorreactor magnético para apoyar el crecimiento celular bajo campos magnéticos estáticos (SMF). Usando la reacción en cadena de la polimerasa (PCR), Los investigadores determinaron el impacto de los SMF en la regulación y expresión de genes relacionados con la osteogénesis, incluido el factor de transcripción 2 relacionado con el runt (Runx2), osteonectina (ON) y proteínas morfogenéticas óseas 2 y 4 (BMP-2 y BMP-4).
Ahora publicado en Informes científicos , los resultados demostraron que las SMF, Los IONP y la matriz de colágeno pudieron estimular la proliferación, producción de fosfatasa alcalina y mineralización de osteoblastos. El proceso se habilitó al influir en las interacciones matriz-celda para influir en la expresión de Runx2, SOBRE, BMP-2 y BMP-4. El modelo de colágeno ofreció información para formar progresivamente un nuevo modelo óseo tridimensional mineralizado y comprender la estimulación magnética en la osteogénesis. Se pueden realizar estudios adicionales con el modelo para aplicaciones en ingeniería de tejidos y medicina regenerativa.
Solo en el Reino Unido, el número de pacientes que sufren fracturas óseas tiene un impacto económico sustancial en la calidad de vida, como lo demuestran los costos para los Servicios Nacionales de Salud (NHS). Durante una lesión ósea, el proceso biológico y mecánico de regeneración fisiológica reemplaza el hueso lesionado con hueso nuevo en el sitio de la lesión. El proceso metabólico es complicado y requiere la interacción de muchos factores, incluyendo factores de crecimiento y diferenciación como hormonas, citocinas y componentes extracelulares; mientras tanto, los factores inadecuados o interrumpidos pueden provocar un retraso en la cicatrización o deterioro / falta de unión del hueso.
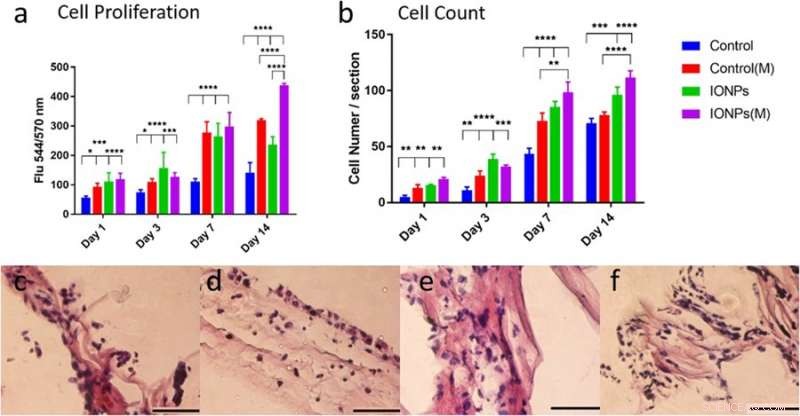
a) comparación de la proliferación de células MG-63 cuando se cultivan con / sin la incorporación de IONP con exposición de SMF (M) y sin exposición de SMF. La proliferación celular se puede mejorar con SMF incorporando IONP, indicando un efecto estimulante, b) Comparar el número de células de las líneas celulares MG-63 a partir de imágenes de histología con o sin SMF. Las respuestas celulares de la línea celular MG-63 cultivada en un andamio de colágeno de PC también se examinaron mediante histología para las condiciones c) sin SMF y sin IONP, d) con SMF, e) con IONP ye) combinar SMF e IONP. Crédito: Informes científicos , doi:10.1038 / s41598-018-33455-2.
En el estudio, los autores utilizaron una novela, modelo de colágeno tridimensional biomimético multifuncional para su uso como plataforma in vitro para estudiar los mecanismos de estimulación magnética en la osteogénesis. Para producir una gama de modelos cargados de células, Los investigadores introdujeron estímulos internos (nanopartículas de óxido de hierro) y externos (campos magnéticos estáticos, SMF) estímulos en el sistema. El material biomimético se diseñó mediante la fabricación de nanoestructuras y microestructuras mediante compresión plástica, según protocolo previamente establecido. Para evaluar los comportamientos biológicos de los osteoblastos, incluida su proliferación, diferenciación, mineralización, análisis de microestructura y expresión génica, los científicos cultivaron el modelo de colágeno en un biorreactor magnético durante hasta 42 días.
En el estudio, Se evaluó la proliferación celular de la línea celular de osteoblastos MG-63 usando el ensayo alamarBlue. En el día 14, los investigadores observaron una diferencia significativa entre los SMF solos, IONPs solos y en su combinación sobre la proliferación celular. Se emplearon técnicas de histología para examinar las respuestas celulares dentro de los andamios de colágeno y comprender el papel de las SMF y las IONP en la proliferación celular. La visualización fue seguida por un análisis cuantitativo del número de células, Los resultados indicaron que la incorporación de IONP prolongaba el efecto de los SMF.
Similar, Se observó diferenciación celular con actividades de fosfatasa alcalina (ALP) para andamios de colágeno, con o sin la incorporación de IONPs. Como antes, cuando se combinó el efecto de IONP y SMF, la producción de ALP se estimuló significativamente en comparación con el tratamiento con SMF solo e IONP solo. La mineralización celular también se observó posteriormente y se cuantificó en el andamio de colágeno sembrado con células. Después de 42 días, todas las muestras se tiñeron con ARS para indicar una mineralización completa. A diferencia de, la combinación de SMF e IONP no pudo promover la mineralización.
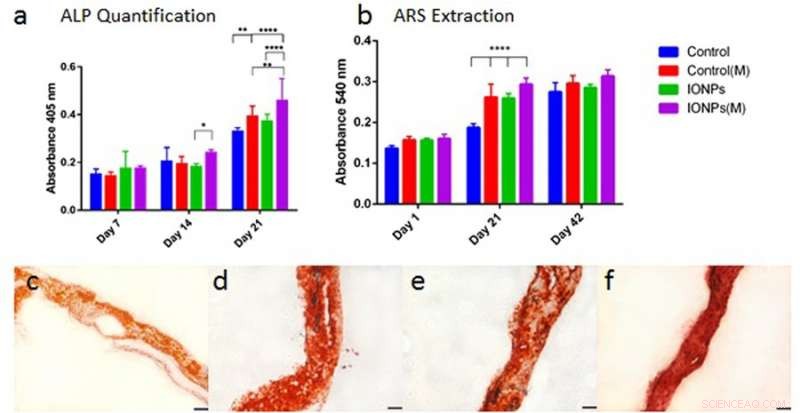
a) comparar la producción de ALP de la línea celular MG-63 cuando se cultiva dentro de andamios de colágeno con o sin la incorporación de IONP, con exposición a SMF (M) y sin exposición a SMF. b) Comparar la mineralización celular extrayendo y cuantificando la tinción ARS de los andamios tratados con o sin exposición a SMF. Los andamios de colágeno cargados con células se integraron con IONP (100 µg / ml) .Los resultados se recopilaron en 1, 21 y 42 días de cultivo. c) tinción ARS del andamio de colágeno en ausencia de SMF e IONP, d) con SMF, e) con IONP, yf) con SMF e IONP. Crédito: Informes científicos , doi:10.1038 / s41598-018-33455-2.
Después de eso, los científicos llevaron a cabo estudios para comprender las respuestas de los andamios de colágeno de células sembradas a los SMF y los IONP a nivel molecular. Para esto, los niveles de expresión de Runx2, SOBRE, BMP-2 y BMP-4 se cuantificaron usando la reacción en cadena de la polimerasa cuantitativa en tiempo real (RT-qPCR). Un tratamiento de 7 días de SMF solo no tuvo efecto sobre la expresión de Runx2, Considerando que se encontró una mayor expresión cuando se combinaron SMF con IONP, demostrando la expresión de Runx2 mediada por la matriz de colágeno durante la osteogénesis. En el día 7, el nivel de expresión de ON en las muestras tratadas con IONP, Los SMF y ambos fueron más altos que en el control en un corto período de tiempo. Durante la expresión de BMP-2 y BMP-4, Se observaron resultados similares a lo largo de 7-14 días.
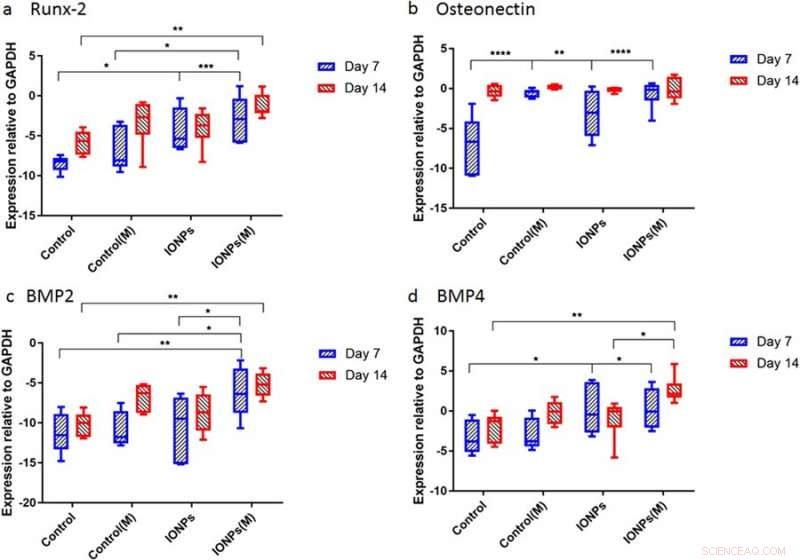
Expresión genética para a) Runx2, b) osteonectina (ON), c) BMP-2 yd) BMP-4 normalizada con el control GAPDH después de 7 y 14 días de cultivo celular. Crédito: Informes científicos , doi:10.1038 / s41598-018-33455-2.
El estudio demostró principalmente la osteogénesis como un proceso complejo mediado por la activación y expresión sucesivas de varios genes clave, incluyendo Runx2, SOBRE, BMP-2 y BMP-4. Típicamente, Runx2 regula al alza la expresión de genes de proteínas relacionados con la matriz ósea para promover la formación de hueso in vitro e in vivo. Respectivamente, el estudio mostró que la exposición a SMF puede inducir la proliferación de la línea celular modulando la expresión temprana de Runx2, para acelerar la osteogénesis. Cuando los IONP se incorporaron a SMF, la expresión del gen de la osteonectina (ON) aumentó, uniendo las fases de colágeno con el mineral óseo para iniciar la mineralización normal del tejido esquelético. Similar, tanto BMP-2 como BMP-4 solo aumentaron en el estudio durante el cultivo celular combinado con SMF e IONP.
De este modo, los autores desarrollaron y probaron un modelo biomimético de colágeno 3-D que podría mineralizarse progresivamente para formar posteriormente un nuevo modelo óseo in vitro. El modelo se incorporó con células osteoblásticas y nanopartículas con la capacidad de responder a estimulaciones magnéticas externas. El modelo de colágeno biomimético se diseñó mediante compresión plástica para integrar la línea celular MG-63 y demostrar resultados reproducibles y consistentes combinados con SMF e IONP. Las interacciones célula-matriz regularon positivamente con éxito la expresión de genes clave relacionados con la osteogénesis. Los autores tienen la intención de desarrollar aún más el modelo 3-D para que sirva como una plataforma superior para investigar comportamientos biológicos in vitro con aplicaciones potenciales en ingeniería de tejidos y medicina regenerativa.
© 2018 Science X Network