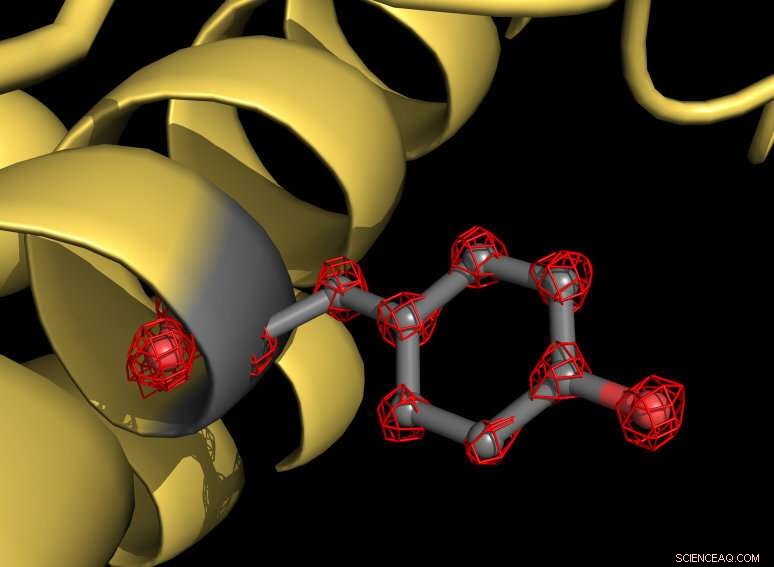
Parte de la proteína apoferritina (amarilla) con una cadena lateral de tirosina resaltada en gris. El aminoácido tirosina consta de varios átomos que se reconocen individualmente en la estructura (estructuras de rejilla roja). Crédito:MPI f. Química biofísica / Holger Stark
Holger Stark del Instituto Max Planck de Química Biofísica en Göttingen y su equipo han roto una barrera de resolución crucial en la microscopía crioelectrónica. Por primera vez, su grupo logró observar átomos individuales en una estructura de proteína y tomar las imágenes más nítidas con este método. Estos conocimientos detallados facilitan la comprensión de cómo las proteínas hacen su trabajo o causan enfermedades en la célula viva. La técnica también se puede utilizar en el futuro para desarrollar nuevos fármacos.
Desde el estallido de la pandemia COVID-19, Científicos de todo el mundo han estado resolviendo estructuras tridimensionales de importantes proteínas clave del nuevo coronavirus. Su objetivo común es encontrar sitios de acoplamiento para un compuesto activo que pueda combatir el patógeno de manera efectiva.
Un método aplicado es la microscopía crioelectrónica (crio-EM), que se puede utilizar para hacer visibles estructuras tridimensionales de biomoléculas. Dado que son estructuralmente muy flexibles, esta no es una tarea fácil. Para capturar las moléculas difusas sin dañarlas, se enfrían extremadamente rápido, o congelado por así decirlo. Las muestras congeladas se bombardean posteriormente con electrones, y se registran las imágenes resultantes. Usando estos, Entonces se puede calcular la estructura tridimensional de las moléculas. Tres pioneros de esta técnica, Jacques Dubochet, Joachim Frank, y Richard Henderson, recibió el Premio Nobel de Química por el desarrollo de cryo-EM en 2017.
El récord mundial de resolución permite ver átomos individuales en proteínas
El grupo de Stark ha roto la barrera de la resolución crio-EM con un microscopio electrónico criogénico único recientemente desarrollado por este equipo. "Equipamos nuestro dispositivo con dos elementos ópticos de electrones adicionales para mejorar aún más la calidad y resolución de la imagen. Estos aseguran que los errores de imagen de las lentes ópticas, las llamadas aberraciones, ya no juega un papel, ", explica el director de Max Planck. Su estudiante de doctorado Ka Man Yip añade:" Los microscopios electrónicos son instrumentos ópticos y se parecen físicamente a una cámara. Las aberraciones de un microscopio electrónico interfieren en la crio-EM de la misma manera que las de una cámara fotográfica. Por tanto, para obtener una calidad de imagen mucho mejor, era fundamental evitar estos errores de aberración ".
Usando el nuevo microscopio, los científicos han tomado más de un millón de imágenes de la proteína apoferritina para mapear la estructura molecular con una resolución de 1,25 angstroms. Un angstrom equivale a una décima de millonésima de milímetro. "Ahora visualizamos átomos individuales en la proteína, un hito en nuestro campo, "explica el biólogo estructural Stark." Para nosotros, era como poner super gafas en el microscopio. La nueva estructura revela detalles nunca antes vistos:incluso podemos ver la densidad de los átomos de hidrógeno y las modificaciones químicas de un solo átomo ".
Los colegas del Laboratorio de Biología Molecular del Consejo de Investigación Médica de Cambridge (Reino Unido) también demostraron el gran potencial de la crio-EM para la obtención de imágenes de estructuras de proteínas en 3D de alta resolución. Alcanzaron una resolución igualmente alta utilizando un enfoque diferente. "Ahora es concebible que cryo-EM en el futuro pueda lograr resoluciones incluso subatómicas, "dice el investigador.
Base para el diseño de fármacos basado en la estructura
Pero, ¿cuál es el beneficio de poder estudiar la estructura de una proteína con una resolución atómica sin precedentes? Para entender cómo funciona una máquina hecha por el hombre, uno tiene que observar sus componentes directamente en el trabajo. Esto también es cierto para las proteínas, las nanomáquinas de las células vivas. Para tener una idea de cómo llevan a cabo sus tareas, hay que conocer la posición exacta de todos los átomos de la proteína.
Estos conocimientos detallados también son relevantes para el diseño de fármacos basado en estructuras. Los compuestos para medicamentos se personalizan de manera que se unen a proteínas virales, por ejemplo, y bloquear su función. Pero, ¿cuál es el mecanismo subyacente de inhibición? Los investigadores solo pueden dilucidar y comprender esto si pueden observar a nivel atómico cómo interactúan un compuesto y una proteína viral. Estos conocimientos novedosos ayudan a mejorar las moléculas de los medicamentos y a reducir los efectos secundarios. "Al romper esta barrera de resolución crio-EM, la técnica ha alcanzado un nivel en el que los beneficios para los desarrollos farmacéuticos son directamente visibles, "dice Stark.