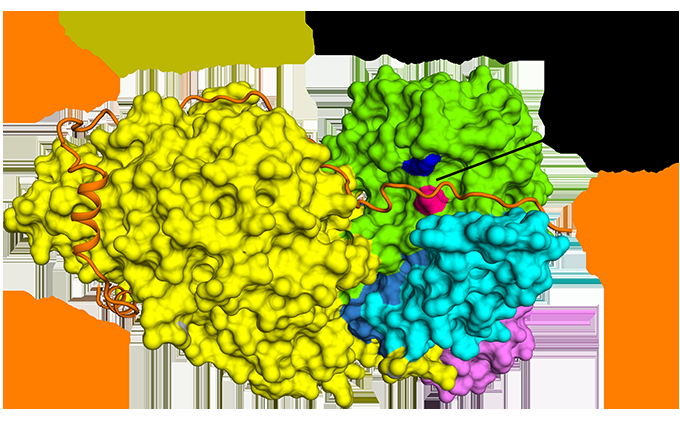
Figura 1:La unión antiparalela de la securina en comparación con la separasa. Crédito:Fuente de luz de diamante
La estructura de un importante complejo de proteínas que regula la transición de metafase a anafase durante la progresión del ciclo celular se ha resuelto mediante microscopía crioelectrónica (crio-EM) en Diamond Light Source. El estudio estructural, detallado en Biología estructural y molecular de la naturaleza , ha proporcionado información valiosa sobre el funcionamiento interno del complejo separasa-securin.
La separasa es una enzima responsable de escindir las subunidades de la kleisina (Scc1 y Rec8) del anillo de cohesina que mantiene unidas las cromátidas hermanas durante la mitosis. Una vez que las cromátidas son liberadas por la separasa, se segregan hacia los polos opuestos de la celda, listo para formar nuevos núcleos en dos células hijas idénticas. Separase se mantiene bajo control por un acompañante inhibidor conocido como securin, que curiosamente también se cree que tiene propiedades activadoras.
Aunque descubierto hace casi 20 años, sólo recientemente se ha dilucidado la estructura de la separasa unida a la securina. Cryo-EM se llevó a cabo en el Electron Bio-Imaging Center (eBIC) en Diamond para determinar la estructura del complejo completo y explorar la interacción molecular entre separasa y securina. Se descubrió que la securina forma una conformación extendida para interactuar a lo largo de toda la longitud de la separasa, e inhibe la enzima a través de un mecanismo de pseudosustrato en el sitio activo. Una comprensión completa de esta interacción y la naturaleza del control del ciclo celular podría abrir nuevas vías para el diseño de fármacos específicos.
Un complejo regulador del ciclo celular
Cuando los cromosomas se replican, cada uno contiene dos cromátidas hermanas, y durante la división celular, estas cromátidas deben separarse de manera coordinada y precisa para producir dos núcleos hijos idénticos. Al comienzo de la mitosis, las cromátidas hermanas se mantienen unidas por un complejo proteico llamado cohesina; sin embargo, durante la transición de metafase a anafase, la cohesina es escindida por una enzima proteasa conocida como separasa para separar las cromátidas y permitirles moverse a lados opuestos de la célula justo antes de dividirse.
La transición de la metafase a la anafase comienza cuando una gran ubiquitina ligasa E3 de múltiples subunidades, llamado complejo promotor de anafase (o APC / C) marca un acompañante inhibitorio, llamado securin, con ubiquitina para su destrucción. Una vez que la securina se degrada, separase es libre de escindir la cohesina y separar las cromátidas.
El complejo separasa-securina es fundamental para la división celular, sin embargo, la estructura de este dúo no se había resuelto en su totalidad. Dr. Andreas Boland, El investigador postdoctoral del grupo del Dr. David Barford en el Laboratorio de Biología Molecular del MRC y co-investigador principal del estudio explicó por qué este complejo es tan fascinante:"La mala segregración de material genético puede conducir a aneuploidía y tumorigénesis, por lo tanto, este es uno de los pasos más importantes durante la progresión del ciclo celular. Paradójicamente, securin no solo previene la escisión prematura de la cohesina, pero también puede promover la actividad de separasa. Para comprender los mecanismos duales de activación y represión en detalle, usamos crio-EM de una sola partícula ".
Estructura Cryo-EM a una resolución de 3,8 Å
Se expresaron complejos separasa-securina de C. elegans y humanos, purificado y se aplica a rejillas de oro-carbono cubiertas con óxido de grafeno antes de congelarse instantáneamente en etano líquido. Se recolectaron micrografías Cryo-EM usando el microscopio Titan Krios en eBIC con un aumento calibrado de 47, 619, que correspondía a un tamaño de píxel de 1,05 Å.
El Dr. Boland destacó el valor de la crio-EM para esta aplicación:"Los complejos de proteínas son de tamaño relativamente pequeño, con menos de 250 kDa para el ser humano y solo alrededor de 150 kDa para el complejo C. elegans, pero contienen varios dominios y son flexibles, por lo que eran materiales desafiantes para cristalizar. Cryo-EM es una opción viable incluso para pequeños complejos de proteínas como este ".
Por primera vez, Cryo-EM se utilizó para determinar la estructura de resolución casi atómica del complejo C. elegans separase-securin. Es más, la estructura del equivalente humano del complejo se resolvió a una resolución media, revelando la conservación evolutiva de la forma triangular de la separasa.
Cryo-EM permitió al equipo visualizar cómo se relaciona securin con separase. Adopta una conformación antiparalela extendida para unirse a parches hidrófobos a lo largo de toda la longitud de la separasa. Curiosamente, También se demostró que estas interacciones hidrofóbicas estabilizan la separasa, potencialmente explicando los efectos activadores de la securina sobre la separasa. Es más, securin interactúa con el sitio catalítico de la separasa a través de un mecanismo de pseudosustrato. Un residuo de arginina presente en la posición de escisión P1 en los sustratos de cohesina Scc1 y Rec8 se reemplaza en securin por un residuo hidrófobo. Esta sustitución es responsable de distorsionar la geometría del sitio catalítico de la separasa en la posición de escisión del sustrato, bloqueando consecuentemente su actividad proteasa.
La separasa es crucial para la progresión del ciclo celular, por lo que podría ser un objetivo farmacéutico interesante. Mutaciones sobreexpresión y se ha demostrado que la localización errónea de separasa está asociada con desarrollos tumorales como el cáncer de mama.
El Dr. Boland planea continuar estudiando el complejo:"En el futuro, queremos mejorar la resolución del complejo humano separasa-securina para lograr una resolución atómica o casi atómica. También nos gustaría entender cómo el complejo de separasa-securina está unido y ubiquitinado por el APC / C para marcarlo para su destrucción. por lo que continuaremos usando cryo-EM para este propósito ".