Figura 1:Dos rayos láser interactúan con moléculas en la superficie del hielo, formando un nuevo rayo con un color diferente. El color y la intensidad de este rayo láser contienen información detallada sobre la estructura molecular de la superficie del hielo. Crédito:Organización de los Países Bajos para la Investigación Científica (NWO)
Es a una temperatura de -70 ° C que las moléculas de agua en la superficie del hielo forman la mayor cantidad de enlaces entre sí. Investigadores de AMOLF, junto con un equipo internacional de colegas, describir esto en un artículo en Cartas de revisión física publicado el 28 de septiembre. Es importante conocer el comportamiento de la capa superior de hielo para comprender cómo se mueven los glaciares, como surgen las avalanchas, y por qué podemos patinar sobre hielo entre otras cosas.
El agua es una sustancia extraña:se expande cuando se congela. Como la forma sólida del agua (hielo) tiene una densidad más baja que la variante líquida, el hielo flota sobre el agua. Esto significa que puedes patinar en un lago durante un invierno riguroso mientras los peces debajo de ti continúan nadando. Esta propiedad inusual es causada por la estructura molecular del agua. Una molécula de agua consta de un átomo de oxígeno con dos átomos de hidrógeno. Los átomos de hidrógeno forman felizmente un enlace fuerte con un átomo de oxígeno de otra molécula de agua:a esto lo llamamos enlace de hidrógeno.
Cada átomo de oxígeno puede unirse a un máximo de cuatro átomos de hidrógeno:dos de su propia molécula de agua, y dos de moléculas cercanas. Eso puede suceder en el centro de un trozo de hielo profundamente congelado, en el que las moléculas de agua asumen una estructura cristalina que parece una colección de hexágonos regulares. Esta estructura de cristal ocupa bastante espacio, y eso es lo que reduce la densidad del hielo.
Sin embargo, las moléculas de agua en la superficie del hielo tienen un problema. Estas moléculas de agua no se encuentran en una interfaz con otras moléculas de agua, sino con el aire, por lo que no pueden utilizar al máximo sus posibilidades de vinculación.
Número máximo de bonos
El investigador de AMOLF, Wilbert Smit, y el líder del grupo AMOLF, Huib Bakker, estudiaron cómo cambia la estructura de la capa más externa de hielo como consecuencia de la temperatura. Descubrieron que a una temperatura ambiente de aproximadamente -70 ° C, las moléculas de agua en la superficie del hielo forman un número máximo de enlaces de hidrógeno. Los investigadores también encontraron una explicación para esto.
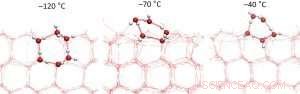
Figura 2:secciones transversales de la superficie del hielo a diferentes temperaturas. La estructura hexagonal comienza a derretirse a temperaturas inferiores a -70 ° C, lo que inicialmente conduce a una mayor densidad de enlaces de hidrógeno en la superficie del hielo. A -70 ° C se alcanza el número máximo de enlaces de hidrógeno. Crédito:Organización de los Países Bajos para la Investigación Científica (NWO)
"Si hace mucho más frío que -70 ° C, entonces la capa más externa del hielo tiene la misma estructura que los hexágonos regulares debajo de ella, pero cuidadosamente cortado por la mitad. Se puede comparar la estructura con una casa semi-construida donde las varillas de hormigón armado todavía sobresalen de las paredes del primer piso ", dice Wilbert Smit.
A medida que sube la temperatura, la superficie del hielo se vuelve menos estructurada debido a que las moléculas de agua adquieren más energía cinética. Como resultado de esto, se reorganizan de tal manera que el número de enlaces entre las moléculas de agua aumenta inicialmente. Esta reordenación produce una mayor densidad de enlaces de hidrógeno a una temperatura de -70 ° C.
A temperaturas superiores a -70 ° C, el número de enlaces entre las moléculas vuelve a disminuir:la capa superior se comporta cada vez más como agua y menos como hielo. Esto significa, por ejemplo, que la superficie del hielo sobre la que patinamos no es realmente hielo, sino una capa de agua.
Simulaciones y técnica sensible
Los investigadores holandeses utilizaron una técnica avanzada para la investigación llamada espectroscopia de generación de frecuencia de suma. Esta técnica permite detectar las vibraciones de las moléculas en las superficies iluminando la superficie con dos intensos rayos de luz láser de femtosegundos. En las condiciones adecuadas, los rayos de luz interactúan con las moléculas de la superficie y se forma un rayo de luz con un color diferente. Esto solo ocurre cuando los rayos se reflejan en la superficie y no en la estructura subyacente. Por lo tanto, el color y la intensidad de la nueva viga contienen exclusivamente información detallada sobre la estructura de la superficie. Con la ayuda de simulaciones del Instituto Max Planck en Mainz, los investigadores pudieron traducir estos resultados en nuevos conocimientos sobre la superficie del hielo.