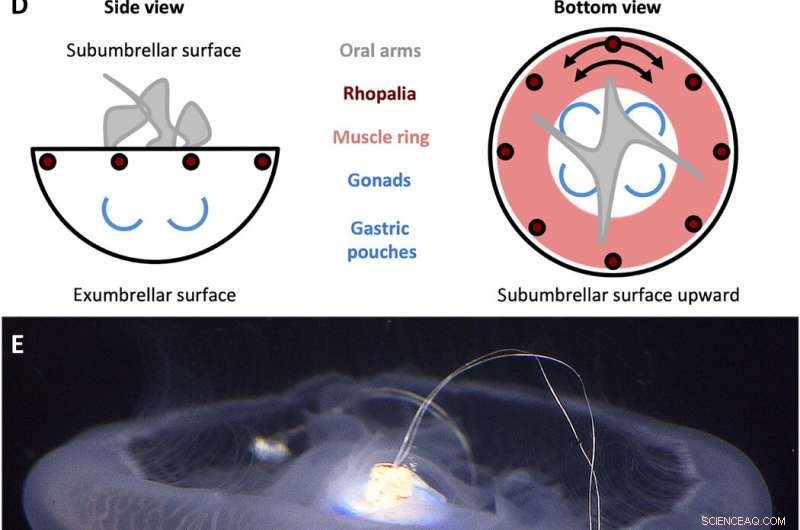
A. Diseño de controlador de natación aurita. (A) Señal de onda cuadrada generada por el controlador de natación con una amplitud (A) de 3.7 V y un ancho de pulso (T) de 10 ms, establecido en frecuencias (f) de 0,25, 0,38, 0,50, 0,62, 0,75, 0,88, y 1,00 Hz. (B) Componentes del controlador de natación. La carcasa incluye (i) una tapa de polipropileno con un pasador de madera que se incrusta en el centro de la campana, y (ii) una película plástica para impermeabilizar la carcasa, ambos compensados con pesos de acero inoxidable y corcho para mantener el dispositivo con una flotabilidad aproximadamente neutra. La microelectrónica incluye (iii) un miniprocesador TinyLily, (iv) batería de polímero de litio, y (v) dos electrodos con punta de platino con LED para indicar visualmente la estimulación. (C) Dispositivo completamente ensamblado, con el procesador y la batería encajados en la carcasa. (D) Esquemas simplificados de la anatomía de A. aurita, resaltando las superficies subumbrellar (superior) y exumbrellar (inferior), ropalia, anillo muscular, y orientación circunferencial de las fibras musculares, brazos orales, y gónadas / bolsas gástricas. (E) Controlador de natación (inactivo) incrustado en una medusa que nada libremente, campana orientada hacia el lado subumbrellar hacia arriba, con la clavija de madera insertada en el manubrio y dos electrodos incrustados en el tejido muscular y mesogleal cerca del margen de la campana. Créditos de las fotos para (B), (C), y (E):Nicole W. Xu, Universidad Stanford. Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Los investigadores en materiales robóticos tienen como objetivo controlar artificialmente la locomoción animal para abordar los desafíos existentes a la actuación, requisitos de control y potencia en robótica blanda. En un nuevo informe en Avances de la ciencia , Nicole W. Xu y John O. Dabiri en los departamentos de bioingeniería, La ingeniería civil y ambiental y la ingeniería mecánica de la Universidad de Stanford presentaron un robot biohíbrido que utilizaba microelectrónica a bordo para inducir la natación en medusas vivas. Midieron la capacidad de mejorar sustancialmente la propulsión impulsando las contracciones del cuerpo en un rango de frecuencia óptimo más rápido que el comportamiento natural. La maniobra aumentó la velocidad de nado casi tres veces, aunque con solo un aumento del doble en el gasto metabólico del animal y 10 mW de entrada de energía externa a la microelectrónica. El robot biohíbrido utilizó de 10 a 1000 veces menos energía externa por masa que los robots acuáticos reportados anteriormente. La capacidad puede mejorar el alcance del rendimiento de los robots biohíbridos en relación con el rendimiento nativo, con aplicaciones potenciales como robots de monitoreo de océanos biohíbridos.
Las medusas son un organismo modelo convincente para formar vehículos submarinos energéticamente eficientes debido a su bajo costo de transporte (COT). Los robots biomiméticos existentes de animales nadadores que están completamente construidos con materiales de ingeniería pueden alcanzar velocidades comparables a las de los animales naturales. pero con órdenes de magnitud menos eficientes que las medusas. Por lo tanto, los robots de medusas biohíbridos pueden integrar animales vivos para abordar los desafíos existentes de la robótica blanda. Los investigadores pueden utilizar la estructura de la medusa para actuar y resolver los requisitos de energía mediante la exploración de los comportamientos de alimentación naturales en los que extraen energía química de la presa in situ. El enfoque también puede permitir la recuperación del daño a través de procesos naturales de curación de heridas inherentes al animal. controlar la locomoción animal y permitir estudios adicionales de la biomecánica de los organismos vivos en experimentos controlados por el usuario. En este estudio, Xu y Dabiri utilizaron un sistema de microelectrónica para controlar externamente una medusa viva y formar un robot biohíbrido para hacer avanzar la ciencia y la ingeniería de la locomoción acuática.
Para activar las medusas como andamio natural, El equipo utilizó el propio metabolismo basal del animal para reducir los requisitos de energía adicionales y aprovechó sus músculos para actuar mientras confiaba en las propiedades de autocuración y regeneración de tejidos para una mayor tolerancia al daño. El equipo planteó la hipótesis de que el aumento de las frecuencias de contracción de campana de las medusas podría aumentar la velocidad de natación hasta un límite. Por lo tanto, controlaron externamente la frecuencia de los pulsos en los animales que nadaban libremente midiendo la velocidad de nado y la ingesta de oxígeno para calcular el costo de transporte (COT) y probar su hipótesis de trabajo. Anteriormente, tales exámenes solo eran posibles a través de modelos computacionales o teóricos.
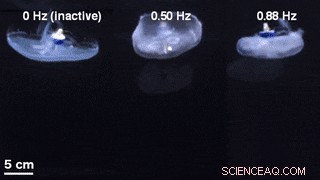
Una comparación de geometrías de campana para natación no estimulada con un controlador de natación inactivo integrado (izquierda) y natación controlada externamente a 0,50 Hz (centro) y 0,88 Hz (derecha). Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Xu y col. seleccionó a Aurelia aurita como organismo modelo; una especie achatada de medusa que contiene una campana mesogleal flexible y una monocapa de músculos coronales y radiales que recubren la superficie subumbrellar. Para nadar los organismos contrajeron los músculos para disminuir el volumen de la cavidad subumbrellar y expulsar agua para proporcionar una fuerza motriz junto con contribuciones adicionales de la recaptura de energía pasiva y la propulsión basada en succión. Para iniciar estas contracciones musculares, la medusa activó cualquiera de sus marcapasos ligeros ubicados en los órganos sensores conocidos como rhopalia a lo largo del margen de la campana. Estos grupos de nervios activaron toda la red de nervios motores para causar propagaciones de ondas musculares bidireccionales que se originaron a partir de los marcapasos activados durante la propagación natural.
Integración de diseño robótico en medusas vivas y validación de dispositivos
Los científicos diseñaron por primera vez un portátil, controlador de natación microelectrónico autónomo para generar una onda de pulso cuadrada y estimular las contracciones musculares de 0,25 Hz a 1,00 Hz. Compusieron el controlador con un miniprocesador TinyLily y una celda de polímero de litio de 10 mAh. Para confirmar visualmente la señal eléctrica, Xu y col. conectó los cables en serie a los diodos emisores de luz (LED) TinyLily. Luego insertaron electrodos bilateralmente en el tejido subumbrellar y mantuvieron el sistema flotante de forma natural con arandelas de acero inoxidable y corcho. Para validar que el controlador de natación podría controlar externamente las contracciones de la campana de las medusas, los científicos desarrollaron un método para rastrear el movimiento del margen de la campana. Para esto, completaron tres conjuntos de experimentos, (1) observar las contracciones endógenas del organismo en ausencia de alteraciones, (2) para observar si la incrustación mecánica de electrodos inactivos afectaba el comportamiento natural del animal y (3) para probar los protocolos de estimulación para confirmar las contracciones impulsadas externamente.
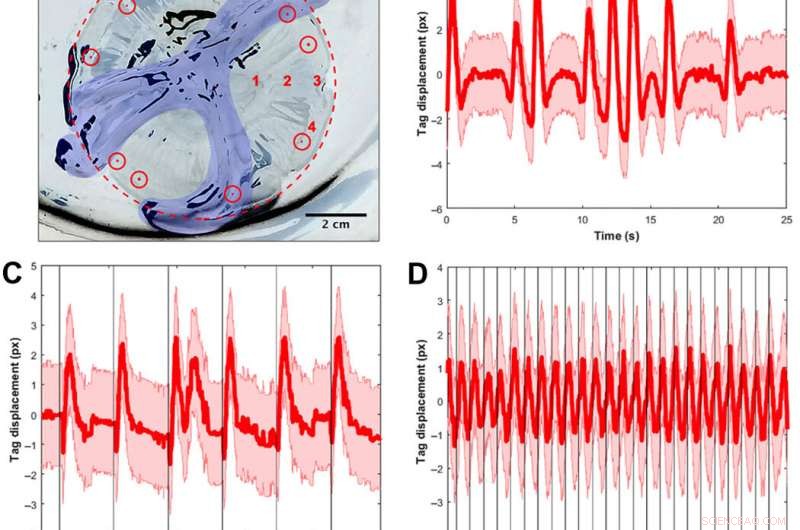
Validación de señales mediante etiquetas visuales y espectros de frecuencia para realizar un seguimiento de las contracciones musculares. (A) A. aurita medusae (n =10, 8,0 a 10,0 cm de diámetro) se colocaron con la superficie subumbrellar hacia arriba en una placa sin agua de mar para experimentos de estimulación muscular restringida (no se muestra el electrodo). La imagen está invertida para que la campana y el plato sean blancos, y las áreas negras son reflejos de luz del tejido animal y la placa. Para mayor claridad, el margen de la campana está delineado en un círculo punteado rojo, y los brazos orales están coloreados en azul. Se inyectaron etiquetas de elastómero de implante visibles (mostradas como puntos rojos de color dentro de círculos rojos) alrededor del margen, y se rastreó una etiqueta por video para calcular el desplazamiento del tejido como sustituto de las contracciones musculares. Se realizaron pruebas espaciales para determinar si la ubicación del electrodo afectaba a los espectros en cuatro ubicaciones, etiquetado con números rojos:(1) adyacente a las bolsas gástricas, (2) a medio camino entre las bolsas gástricas y el margen, (3) en la ropalia, y (4) en el margen alejado de la rhopalia. Todas las demás pruebas se realizaron en la ubicación 2. (B) Ejemplo de desplazamiento de la etiqueta en función del tiempo para un animal sin ningún estímulo externo. La línea roja indica el desplazamiento del centroide, con el error calculado asumiendo una incertidumbre de medio píxel al encontrar el centroide de la etiqueta en cada imagen, más de 25 s. Tenga en cuenta la variación temporal de las contracciones musculares, incluyendo períodos de pulsos regulares y sucesivos pulsos rápidos. (C) Ejemplo de desplazamiento de etiqueta para un animal con un estímulo externo de 0.25 Hz, con cada estímulo visualizado como una línea negra vertical. Aunque las contracciones siguen regularmente estímulos externos, Los pulsos de animales naturales también ocurren a bajas frecuencias. Nota, por ejemplo, el doble pulso después de un estímulo (t ≈ 12 s). (D) Ejemplo de desplazamiento de etiqueta para un animal con un estímulo externo de 1.00 Hz, con cada estímulo visualizado como una línea negra vertical. Se muestra la misma ventana de tiempo (25 s) para una comparación justa con los dos gráficos anteriores. Las contracciones siguen regularmente estímulos externos. (E) espectro de amplitud de un solo lado (SSAS) promediado para medusas sin ningún estímulo externo (n =12 para 10 animales, es decir., 2 medusas tenían dos clips repetidos cada una). La línea roja indica la media de SSAS normalizada para cada réplica, con la SD en rosa. El pico del SSAS medio está en 0,16 Hz. El ancho completo a la mitad del máximo (FWHM) es de 0,24 Hz. (F) Respuesta de las medusas a un electrodo inactivo incrustado (n =14 para 10 animales, es decir., 4 medusas tenían dos clips repetidos cada una). El pico del SSAS medio está en 0,18 Hz. El FWHM es 0,16 Hz. Usando una prueba t de dos muestras de las frecuencias pico para ambos grupos, la diferencia entre las dos muestras fue estadísticamente insignificante (P =0,68). (G) Muestra SSAS para un estímulo eléctrico a 1,00 Hz (n =10 medusas para una señal de entrada de 4,2 V y 4,0 ms). La frecuencia pico ocurre a 1.02 Hz, dentro de la ventana de 0.02 utilizada para calcular el SSAS. Tenga en cuenta que el espectro tiene un pico más agudo en la frecuencia de interés (FWHM de 0,04 Hz), a diferencia de un FWHM más amplio en (B) y (C), los casos sin ningún estímulo externo. (H) Mapa de contorno de la respuesta de frecuencia de las contracciones musculares a los estímulos eléctricos externos. Cada línea vertical de datos (centrada en líneas blancas en 0,25, 0,50, 0,75, 1,00, 1,20, 1,50, y 2,00 Hz) representa la PSD a una frecuencia de entrada eléctrica, con el número de medusas analizadas que se muestra arriba. Los colores corresponden a la amplitud del PSD, en el que los valores más altos se muestran en amarillo y los valores más bajos en azul. La línea roja continua representa una respuesta de entrada-salida de uno a uno, y la línea roja discontinua representa el límite fisiológico informado según el período refractario absoluto mínimo del músculo A. aurita (32). Los ensayos de respuesta se definen por si las frecuencias máximas en la PSD se encuentran dentro de una ventana de 0,06 Hz de la curva roja sólida. (I) Mapas de contorno de los ensayos que no responden. También se probaron frecuencias más altas de hasta 90,00 Hz con PSD que no respondían similares. Crédito de la foto para (A):Nicole W. Xu, Universidad Stanford. Crédito:Science Advances, doi:10.1126 / sciadv.aaz3194
Descubrieron que el comportamiento natural de los animales (o contracción endógena) era irregular con una alta variabilidad de la frecuencia del pulso, incluida una frecuencia máxima media de 0,16 Hz. Un electrodo inactivo no cambió significativamente los espectros de frecuencia, mientras que las contracciones impulsadas externamente mostraron un límite fisiológico de las contracciones de los músculos de las medusas entre 1.4 Hz y 1.5 Hz. El equipo realizó pruebas de natación con el sistema implantado en un tanque de agua salada y normalizó las velocidades de natación medidas para tener en cuenta la variación en el tamaño del animal. Escalaron la velocidad de nado normalizada por la media de la velocidad normalizada en ausencia de estimulación (es decir, 0 Hz) para determinar el factor de mejora. El factor de mejora máximo fue de hasta 2,8 veces la velocidad de natación natural de los animales, es decir., la velocidad de nado se ha mejorado hasta 2,8 veces gracias a la microelectrónica a bordo.
Consumo de energía del dispositivo altamente eficiente
Las medusas controladas artificialmente requerían energía externa del sistema microelectrónico y energía interna del propio metabolismo de los animales. Cuando se maneja a frecuencias crecientes, el sistema microelectrónico de las medusas robóticas biohíbridas consumió más Watts por kg. Sin embargo, en comparación con los robots existentes, este robot biohíbrido utilizó hasta 1000 veces menos energía externa. Xu y col. comparó este prototipo con el rayo medusoide y robótico hecho de cardiomiocitos de rata sembrados en andamios de silicio, y con robots puramente mecánicos, así como con vehículos submarinos autónomos (AUV). Además de los beneficios económicos del bajo consumo de energía externa por masa del robot biohíbrido, el sistema microelectrónico solo cuesta menos de $ 20 en componentes disponibles comercialmente. La electrolocalización también fue inespecífica y los animales se recuperaron inmediatamente después de los experimentos.
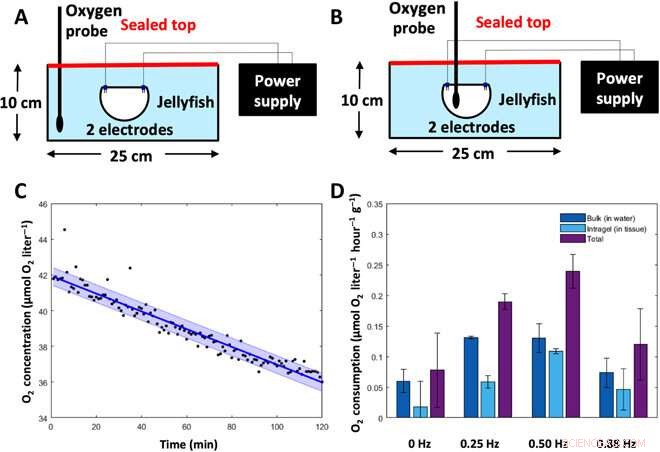
Experimentos de tasa metabólica. Para determinar la tasa metabólica de las medusas, Las concentraciones de oxígeno se midieron en el tejido animal y el agua circundante y luego se convirtieron en gasto de energía. (A) Experimental setup to measure bulk dissolved oxygen concentrations (in the water). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Oxygen levels in the water were measured using a MicroOptode oxygen probe. (B) Experimental setup to measure intragel oxygen concentrations (in the tissue). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Intragel oxygen levels were measured using a MicroOptode oxygen probe embedded into the tissue. (C) Representative plot of oxygen concentrations over time, measured from the MicroOptode. This example shows measurements of bulk oxygen levels in the water surrounding an animal with a swim controller–driven frequency of 1.00 Hz. Individual data points are shown in black, the best-fit line is shown in dark blue, and the SD is shown in the light blue shaded region. (D) Oxygen consumption rates of the surrounding water (dark blue), within animal tissue (light blue), and total (sum of the water and tissue measurements, purple) were calculated over a 6- to 8-hour period (n =7 animals).Credit:Science Advances, doi:10.1126/sciadv.aaz3194
The new capability of external control allowed Xu et al. to address the relationship between swimming frequency and metabolic rate. Oxygen consumption rates followed a similar pattern to enhanced swimming speeds, and the scientists calculated the equivalent cost of transport using both experimental metabolic rates and experimental swimming speeds. The COT increased at mid-range frequencies and decreased at high external stimulation frequencies. The results showed that enhanced jellyfish swimming did not cause undue cost to the metabolism or health of the animal.
The main robotic limit of the study was the power requirement of the microelectronic system relative to animal versus microelectronic power needs. Further improvement to microelectronics can decrease the energetic costs and extended studies can also strive to minimize endogenous animal contractions without harming the organism to improve controllability of live-animal-based biohybrid robots. The artificial control of jellyfish can expand ocean monitoring techniques with improved controllability by incorporating microelectronic sensors to leverage the existing tagging technology.
© 2020 Science X Network