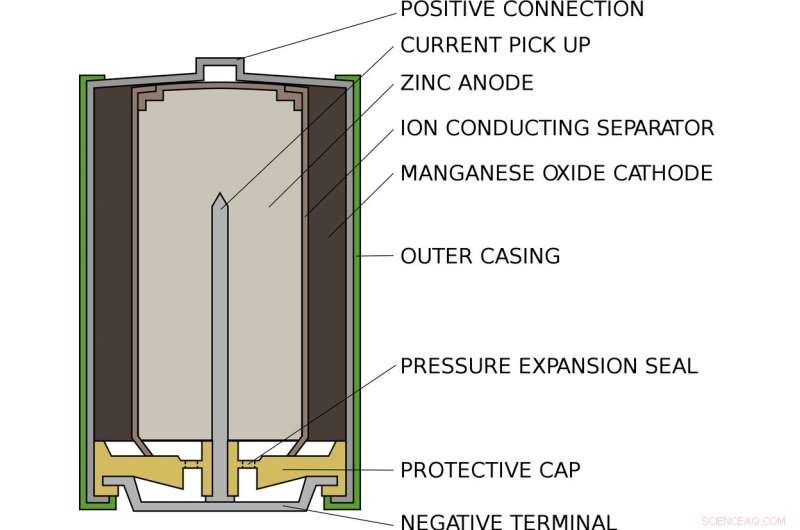
Cómo se ve una pila alcalina AA estándar por dentro. Crédito:Titular principal / Wikimedia Commons
La era de los teléfonos inteligentes tiene solo poco más de una década, pero las computadoras de bolsillo en el corazón de esa transformación social solo son realmente posibles gracias a otra tecnología:las baterías de iones de litio.
Vendido comercialmente por primera vez en 1991 por Sony para sus videocámaras, Estos tipos de baterías sirven para mucho más que para la electrónica de consumo portátil. Están en el centro de otras dos revoluciones tecnológicas con el poder de transformar la sociedad:la transición de los motores de combustión interna a los vehículos eléctricos, y el cambio de una red eléctrica alimentada por combustibles fósiles a generadores de energía renovable que almacenan el excedente de electricidad en baterías para uso futuro.
Entonces, ¿cómo funcionan estas baterías? Los científicos e ingenieros han pasado toda su carrera tratando de construir mejores baterías y todavía hay misterios que no comprendemos completamente. La mejora de las baterías requiere que los químicos y físicos observen los cambios a nivel atómico, así como ingenieros mecánicos y eléctricos que pueden diseñar y ensamblar los paquetes de baterías que alimentan los dispositivos. Como científico de materiales en la Universidad de Washington y el Laboratorio Nacional del Noroeste del Pacífico, mi trabajo ha ayudado a explorar nuevos materiales para baterías de litio-aire, baterías de magnesio y, por supuesto, baterías de iones de litio.
Consideremos un día en la vida de dos electrones. A uno de ellos lo llamaremos Alex y tiene un amigo llamado George.
Anatomía de la batería
Alex vive dentro de una pila AA alcalina estándar, como en tu linterna o mando a distancia. Dentro de una batería AA, hay un compartimento lleno de zinc y otro lleno de óxido de manganeso. En un extremo, el zinc solo se adhiere débilmente a los electrones como Alex. En el otro extremo, el óxido de manganeso atrae poderosamente los electrones hacia sí mismo. Entre, evitar que los electrones vayan directamente de un lado a otro, es un trozo de papel empapado en una solución de potasio y agua, que coexisten como iones potasio positivos e iones hidróxido negativos.
Cuando la batería se coloca en un dispositivo y se enciende, El circuito interno del dispositivo está completo. Alex es sacado del zinc a través del circuito y en el óxido de manganeso. Por el camino, su movimiento alimenta el dispositivo, o bombilla o lo que esté conectado a la batería. Cuando Alex se va, no puede regresar:el zinc que ha perdido un electrón se une al hidróxido para formar óxido de zinc. Este compuesto es extremadamente estable y no se puede convertir fácilmente en zinc.
En el otro lado de la batería, el óxido de manganeso gana un átomo de oxígeno del agua y deja iones de hidróxido para equilibrar el hidróxido que consume el zinc. Una vez que todos los vecinos de Alex dejaron el zinc y pasaron al óxido de manganeso, la batería está agotada y debe reciclarse.
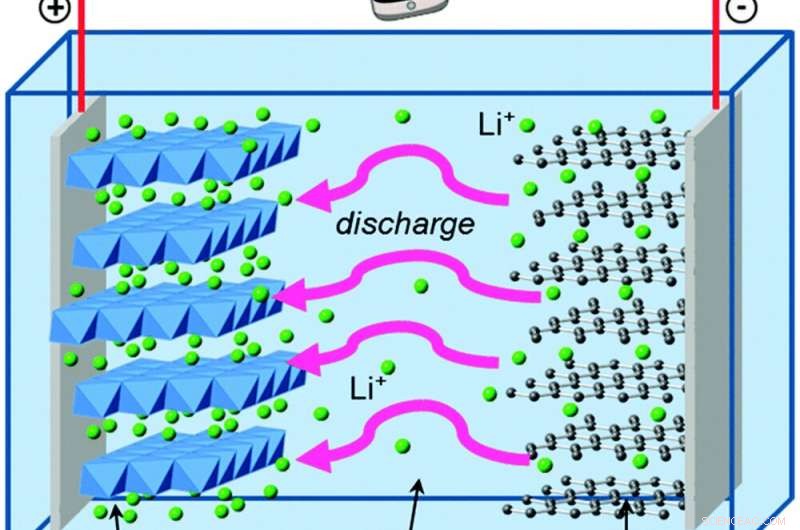
A medida que los electrones se mueven fuera de la batería, Los iones de litio se mueven en su interior para mantener el equilibrio eléctrico. Crédito:Islam y Fisher, Reseñas de la Sociedad Química, 2014., CC BY
Ventajas de los iones de litio
Comparemos esto con George, que vive en una batería de iones de litio. Las baterías de iones de litio tienen los mismos componentes básicos que las pilas AA alcalinas, con algunas diferencias que le confieren importantes ventajas.
George vive en grafito, que es incluso más débil que el zinc para retener electrones. Y la otra parte de su batería es óxido de cobalto y litio, que atrae electrones con mucha más fuerza que el óxido de manganeso, lo que le da a su batería la capacidad de almacenar mucha más energía en la misma cantidad de espacio que una batería alcalina. La solución que separa el grafito y el óxido de cobalto de litio contiene iones de litio cargados positivamente, que forman y rompen fácilmente enlaces químicos cuando la batería se descarga y recarga.
Esas reacciones químicas son reversibles, a diferencia de la formación de óxido de zinc, que es lo que permite que los electrones y los iones de litio fluyan hacia adelante y hacia atrás durante muchos ciclos de carga y descarga.
Este proceso no es 100% eficiente, sin embargo, todas las baterías eventualmente pierden su capacidad de retener energía. Sin embargo, la familia de productos químicos de iones de litio ha sido lo suficientemente poderosa como para dominar la tecnología de baterías en la actualidad.
Este artículo se ha vuelto a publicar de The Conversation con una licencia de Creative Commons. Lea el artículo original. 