En 1869, Dmitri Mendeleev publicó un artículo titulado "Sobre la relación de las propiedades de los elementos con sus pesos atómicos". En ese documento, produjo una disposición ordenada de los elementos, enumerándolos en orden de peso creciente y organizándolos en grupos basados en propiedades químicas similares. Aunque quedaban muchas décadas antes de que se descubrieran los detalles de la estructura atómica, la tabla de Mendeleev ya organizaba elementos en términos de su valencia.
Elementos y peso atómico
En el tiempo de Mendeleev se pensaba que los átomos eran entidades indivisibles y únicas. . Algunos eran más pesados que otros, y parecía razonable ordenar los elementos aumentando el peso. Hay dos problemas con este enfoque. Primero, medir el peso es una tarea difícil, y muchos de los pesos aceptados de la época de Mendeleev no eran correctos. En segundo lugar, resulta que el peso atómico no es realmente el parámetro relevante. Las tablas periódicas de hoy colocan los elementos en orden de su número atómico, que es el número de protones en el núcleo. En la época de Mendeleev, aún no se habían descubierto protones.
Elementos y propiedades químicas
Mendeleev escribió que "la disposición según el peso atómico corresponde a la valencia del elemento y, en cierta medida, la diferencia en el comportamiento químico ". La valencia, en la comprensión de Mendeleev, era una indicación de la capacidad de un elemento para combinarse con otros elementos. Mendeleev combinó el orden del peso atómico con valencias comunes para organizar los elementos en una tabla. Es decir, organizó los elementos en grupos según sus características químicas. Debido a que esas propiedades se repiten de vez en cuando, el resultado fue una tabla periódica en la que cada columna vertical, llamada grupo, contiene elementos con características similares, y cada fila horizontal, llamada punto, organiza los elementos por peso, aumentando de izquierda a derecha y de arriba a abajo.
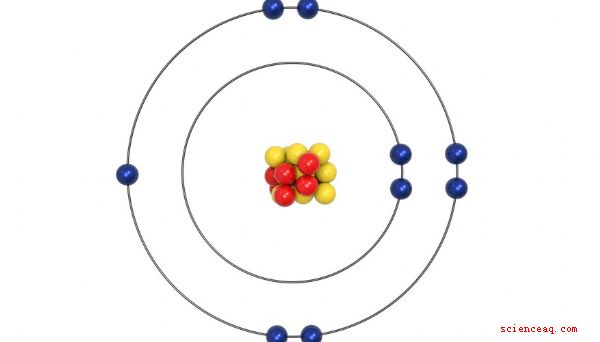
Estructura atómica
Aproximadamente 50 años después de la primera tabla periódica de Mendeleev, los científicos descubrieron que el átomo estaba construido alrededor de un núcleo con protones cargados positivamente y neutrones neutros, los cuales son relativamente pesados. El núcleo cargado positivamente está rodeado por una nube de electrones cargados negativamente. El número de protones, también llamado número atómico, generalmente coincide con el número de electrones. Resulta que la cantidad de electrones que tiene un elemento determina en gran medida sus propiedades químicas. Por lo tanto, el orden correcto en la tabla periódica está determinado por el número de electrones, no por el peso como propuso originalmente Mendeleev.
Electrones de valencia
Los electrones en la nube que rodea el núcleo de un elemento están dispuestos en capas, llamadas capas . Cada capa tiene un número específico de electrones que puede contener. Cuando se llena cada capa, se agrega una nueva capa hasta que se tienen en cuenta todos los electrones. Los electrones en la capa más externa se llaman electrones de valencia, porque son sus interacciones las que determinan las propiedades químicas de un elemento. Las columnas que se configuraron para agrupar elementos por propiedades químicas similares resultan ser exactamente las mismas columnas definidas por el número de electrones de valencia. Los elementos en el grupo 1A tienen solo un electrón de valencia, y cada columna del grupo A a la derecha agrega un electrón de valencia más. La organización se vuelve un poco turbia con los elementos del Grupo B, pero cada uno de ellos también se agrupa por su número de electrones de valencia.