Los péptidos son biomoléculas que se forman cuando se unen dos o más aminoácidos que realizan funciones clave en el organismo humano, como hormonas, neurotransmisores, analgésicos y antibióticos. Por este motivo, son muy estudiados y utilizados por la industria farmacéutica, por ejemplo.
Un estudio realizado por científicos del Departamento de Biofísica de la Facultad de Medicina de la Universidad Federal de São Paulo (EPM-UNIFESP) en Brasil identificó cambios significativos en las propiedades fisicoquímicas de los péptidos durante un proceso espontáneo de cambio químico llamado piroglutaminación.
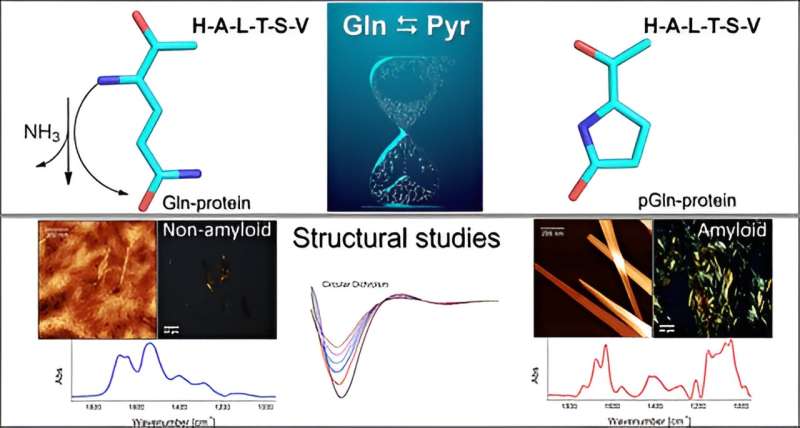
La piroglutaminación es una modificación resultante de la conversión espontánea de glutamina en ácido piroglutámico, con un impacto significativo en las propiedades físicas y químicas de los péptidos. Es una parte de la síntesis de péptidos bien conocida, pero frecuentemente pasada por alto, y rara vez se explora en proteómica.
Los investigadores que realizaron el estudio enfatizan que puede ocurrir rápidamente y se acelera a medida que aumenta la temperatura, subrayando la necesidad de tener precaución durante los experimentos de laboratorio para prevenir la ciclación de la glutamina. Es especialmente importante en condiciones que imitan entornos fisiológicos donde las temperaturas están en el rango de 37 °C, la temperatura normal de un organismo humano sano.
El descubrimiento tiene implicaciones para la investigación de laboratorio y abre nuevas perspectivas para el estudio de enfermedades neurodegenerativas como el Alzheimer y el Parkinson, ya que tras la modificación química la molécula adquiere una estructura amiloide, que favorece la agregación de moléculas, formando placas como las que se cree que causan las enfermedades. en cuestión.
Se publica un artículo sobre el estudio en Biochemistry .
El grupo llevó a cabo experimentos in vitro para investigar el mecanismo por el cual el aminoácido glutamina (Gln) se convierte en ácido piroglutámico (Pyr) en presencia de una secuencia peptídica o proteica en el extremo N-terminal. Este proceso se produce mediante la desamidación, reacción que elimina el amoniaco (NH3 ). Pyr (también llamado piroglutamato) es un aminoácido cíclico formado como resultado de la deshidratación del glutamato. Todas las proteínas constan de múltiples aminoácidos unidos entre sí mediante enlaces peptídicos, con variaciones en el número y secuencia de aminoácidos.
"El resultado puede servir como modelo para muchos investigadores que trabajan con péptidos. Llegamos a dos hallazgos clave. Volvimos a un viejo tema, que es cómo la glutamina se descompone en ácido piroglutámico, pero introdujimos una advertencia sobre la importancia de analizar la secuencia. El segundo punto fue que después de la conversión del péptido, sus características cambian y tiende a adherirse a las membranas."
"La presencia de ácido piroglutámico favorece la formación de agregados amiloidogénicos, similares a los conglomerados que se encuentran típicamente en los casos de enfermedades neurodegenerativas. Estas placas amiloides se forman en el cerebro e interrumpen el flujo de las neuronas", dijo Clovis Ryuichi Nakaie, último autor del estudio. artículo.
La secuencia peptídica modelo (QHALTSV-NH2) utilizada en el estudio se originó en el Ph.D. investigación de Mariana Machado Leiva Ferreira, primera autora del artículo, mientras buscaba la síntesis de unas dos docenas de péptidos presentes en las secuencias de cinco receptores acoplados a proteína G (GPCR) que variaban en tamaño hasta cerca de 20 aminoácidos. Los GPCR capturan una amplia gama de señales extracelulares (que van desde fotones hasta iones, proteínas, neurotransmisores y hormonas) y activan vías de señalización dentro de las células.
Uno de los péptidos sintetizados por Ferreira se destacó por su bajo rendimiento y fue el único que tenía glutamina en el extremo amina. "Después del primer intento de síntesis con un rendimiento muy bajo, variamos varios parámetros para aumentar la producción del péptido, incluidos cambios en la parte sintética y en el proceso de purificación, pero desafortunadamente siempre se degradó parcialmente", dijo.
Cuando el grupo probó soluciones utilizadas con frecuencia en experimentos proteómicos, descubrieron que la conversión de glutamina en ácido piroglutámico se producía en todas ellas en función del tiempo, de acuerdo con una cinética típica de primer orden, donde la tasa de conversión era proporcional al tiempo necesario. por la reacción. Luego decidieron no agitar la solución para poder inferir el ritmo de conversación. Por ejemplo, estimaron que después de cinco horas al menos el 10% de la glutamina probablemente se convertía en ácido piroglutámico.
Un cambio estructural menor desencadenado cuando el péptido nativo fue piroglutaminado en el extremo N-terminal fue suficiente para cambiar el comportamiento fisicoquímico de la molécula.
"Debido a que es cíclico y tiene una carga positiva menos, el péptido Pyr debería ser más hidrófobo que la molécula nativa y, por lo tanto, esperábamos que el análogo interactuara con sistemas miméticos de membrana. Lo que no previmos fue que el análogo implicaría la formación de estructuras amiloides como las que se observan en las enfermedades neurodegenerativas. No estudiamos ninguna de ellas, pero nuestros resultados apuntan en esa dirección", dijo a Agência FAPESP Emerson Rodrigo da Silva, penúltimo autor del artículo. Silva y Nakaie son los autores correspondientes.
Nakaie destacó la importancia de los cambios postraduccionales en el organismo que involucran la cadena polipeptídica. Desempeñan un papel en la diversidad funcional de las proteínas y permiten la adaptación de una secuencia de aminoácidos codificada por un gen para realizar diversas funciones reguladoras.
"En este contexto, el tiempo como factor siempre se correlacionará con la aparición de cambios, independientemente de su velocidad o de su ubicación en nuestro organismo. Esto recuerda la idea del reloj biológico y es la razón por la que sugerimos poner un reloj de arena en la portada. del diario para simbolizar la conversión espontánea de Gln en Pyr", dijo Nakaie.
Es docente de EPM-Unifesp desde hace 45 años y destacó el trabajo pionero realizado por el grupo en el Departamento de Biofísica. En particular, destacó, introdujeron en Brasil la síntesis y bioquímica de péptidos y derivados de aminoácidos.
"Sin duda, nuestros hallazgos allanarán el camino para futuros estudios. Después de completar el trabajo del que formó parte la investigación doctoral de Mariana Ferreira, también queremos continuar con esta línea de investigación", afirmó.
Más información: Mariana M. L. Ferreira et al, Cambios inducidos por piroglutaminación en las características fisicoquímicas de un péptido de quimiocina CXCR4:análisis cinético y estructural, Bioquímica (2023). DOI:10.1021/acs.biochem.3c00124
Información de la revista: Bioquímica
Proporcionado por la FAPESP