Los componentes básicos de nuevos medicamentos que ayuden a combatir las bacterias resistentes a los antibióticos conocidos, por ejemplo, deberían ser lo más rentables y respetuosos con el medio ambiente posible. Las enzimas son ideales para este propósito. Por ejemplo, pueden producir o combinar diferentes componentes de sustancias activas.
En su tesis de maestría en el grupo de Biotecnología Microbiana de la Universidad del Ruhr en Bochum, Simon Schröder caracterizó con más detalle una enzima que es capaz de formar el enlace nitrógeno-nitrógeno deseado en las moléculas. También encontró otras enzimas que pueden hacer esto. El trabajo se publica en la revista Molecular Catalysis .
Los investigadores compiten constantemente con microorganismos dañinos que desarrollan resistencia a los antibióticos. En la búsqueda de nuevas sustancias activas, tradicionalmente se intenta aislar de la naturaleza microorganismos que presenten un comportamiento antibiótico. Luego identifican las sustancias responsables y estudian su función. Hoy en día, este proceso se complementa con métodos asistidos por ordenador que permiten diseñar nuevas moléculas hechas a medida que tienen efectos específicos sobre los organismos y sus procesos metabólicos.
"Sin embargo, el diseño y la producción de este tipo de compuestos artificiales a menudo están limitados por las moléculas precursoras o los componentes básicos disponibles para su producción", explica Schröder. Idealmente, su proceso de producción debería ser económico y ecológico, mediante el uso de microorganismos o sus enzimas catalíticas, por ejemplo. Por lo tanto, la ampliación del sistema modular de moléculas disponibles para producir nuevos fármacos es igualmente importante e interesante.

Hacer más fácilmente accesible el vínculo deseado
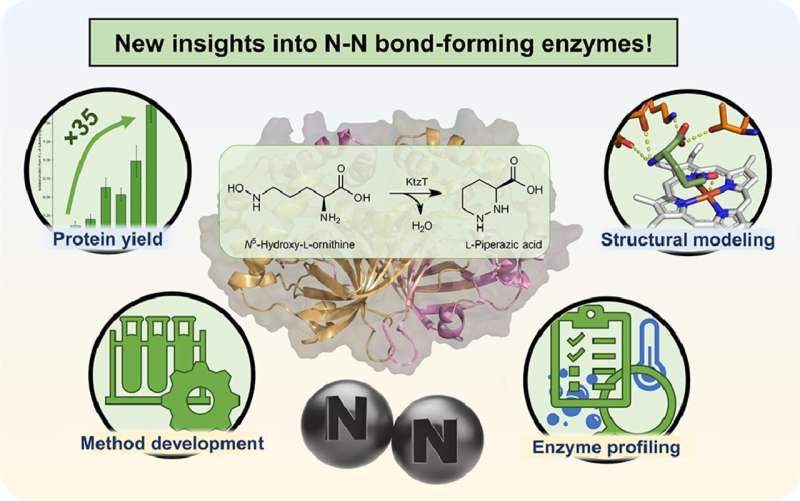
"Estamos trabajando en la producción de un tipo específico de estas moléculas", explica Schröder. En 2017, se aisló una enzima que puede formar el enlace nitrógeno-nitrógeno en las moléculas, algo que rara vez se encuentra en la naturaleza. Sin embargo, todavía se sabe muy poco sobre esta enzima con el nombre sistemático "KtzT":¿Cómo funciona? ¿En qué compuestos puede formar este enlace? ¿Es adecuado para producir moléculas farmacéuticamente relevantes?
"Al principio pudimos mejorar la producción y el aislamiento de esta enzima en el laboratorio en un factor de 35", informa Schröder. "Esto nos permitió caracterizar KtzT, es decir, identificar sus condiciones óptimas de reacción:¿a qué temperatura, qué valor de pH funciona mejor y qué tan estable es en una amplia gama de condiciones?"
El equipo de investigación también encontró y aisló enzimas similares a KtzT y demostró que también pueden catalizar la reacción. "También pudimos implementar una reacción de varios pasos con varias enzimas, lo que facilitó aún más el acceso al enlace nitrógeno-nitrógeno", dice Schröder.
Entre otras cosas, utilizó métodos bioinformáticos para desarrollar un modelo estructural de la enzima, que permite formular hipótesis sobre el mecanismo de reacción y modificar específicamente la enzima para que también pueda formar el enlace nitrógeno-nitrógeno en otros compuestos. /P>
Más información: Simon Schröder et al, Mejora de la formación de enlaces N-N biocatalíticos con la piperazato sintasa actinobacteriana KtzT, Catálisis molecular (2023). DOI:10.1016/j.mcat.2023.113733
Proporcionado por Ruhr-Universitaet-Bochum