Desde el Parkinson y el Alzheimer hasta las arritmias cardíacas, los amiloides están relacionados con una serie de enfermedades. Estos agregados de proteínas se forman en el cuerpo cuando una proteína pierde su estructura normal y se plega mal o muta. Y dado que muchas de estas proteínas son grandes y complicadas, cómo se producen y se agregan algunas de estas mutaciones sigue siendo un misterio, al igual que la creación de tratamientos eficaces.
Una nueva investigación sobre el glaucoma dirigida por químicos de Georgia Tech y un exalumno puede ayudar a cambiar esta situación.
"Se ha trabajado mucho para comprender cómo las proteínas plegadas más pequeñas forman agregados amiloides, pero este estudio nos ayuda a comprender la vía de agregación de un sistema más grande y complejo", dice la coautora Emily Saccuzzo. Ese trabajo podría algún día ayudar a los científicos a descubrir nuevos modos de tratamiento, no sólo para el glaucoma, sino también para otras enfermedades causadas por la agregación de proteínas.
Saccuzzo inició el proyecto en 2018 como estudiante de posgrado en el Laboratorio Lieberman de la Facultad de Química y Bioquímica de Georgia Tech y ahora es investigador asociado postdoctoral en Pacific Northwest National Labs.
"Emily era estudiante de verano antes de matricularse y estableció la viabilidad inicial de realizar estos experimentos", dice Raquel Lieberman, profesora y catedrática de Química Sepcic Pfeil en Georgia Tech. "Estoy inmensamente orgulloso de ella."
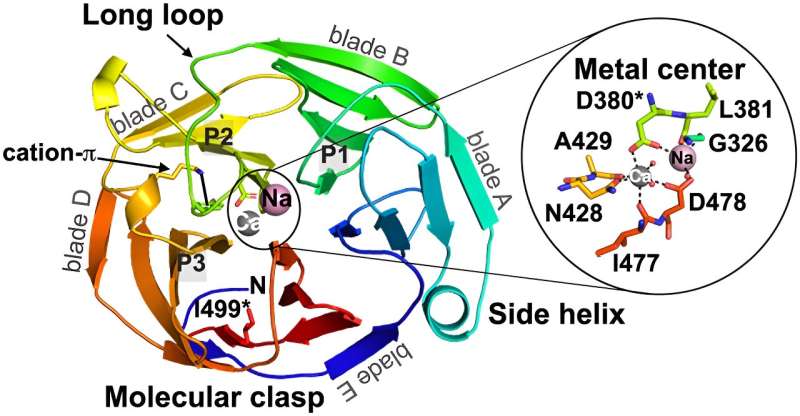
Los hallazgos recientes de su equipo de investigación aparecen en un artículo, "Competencia entre el despliegue de adentro hacia afuera y la agregación patógena en una hélice β formadora de amiloide", publicado en la revista Nature Communications. .
Lieberman y Saccuzzo reunieron a investigadores de todo el Instituto y de fuera de él para colaborar en el estudio.
"Este fue un proyecto muy multidisciplinario y eso siempre es realmente satisfactorio", dice Lieberman. "Creo que cuando reúnes a más personas, puedes responder preguntas difíciles y hacer más de lo que puedes hacer por tu cuenta".
Si bien muchos estudios se han centrado en proteínas más pequeñas, llamadas proteínas modelo, que han establecido "reglas" y patrones conocidos para la formación de amiloide (un tipo especializado de agregación de proteínas), la proteína que contribuye al glaucoma es más grande y más compleja. Este tipo de proteína más grande y complicada está relativamente poco estudiada.
"Hacía tiempo que sabíamos que las mutaciones en la miocilina pueden hacer que la proteína se pliegue y agregue incorrectamente, lo que a su vez conduce al glaucoma", dice Saccuzzo. "Lo que no sabíamos, sin embargo, era el mecanismo exacto por el cual esta proteína se pliega mal y se agrega.
"El objetivo de este estudio era determinar cómo se plegan mal los mutantes de enfermedades, con la esperanza de que eso nos dé una idea de los primeros pasos en la vía de agregación", añade.
Ubicada en la interfaz entre la parte blanca del ojo y el iris coloreado, la proteína forma un pequeño anillo alrededor del ojo.
"Cada vez que parpadeas, estiras ese músculo. Cada vez que el viento sopla muy fuerte o te entra algo en el ojo. Cada vez que te frotas el ojo, podrías estar afectando esta proteína, incluso cuando no esté causando enfermedad", Lieberman dice.
Aún así, los científicos no están seguros de qué hace la proteína. "Sólo sabemos lo que hace cuando causa problemas", como el glaucoma, explica. "No sabemos cuál es su función biológica real."
Inicialmente, a Lieberman le atrajo la idea de estudiar la proteína porque se preguntaba si la investigación realizada sobre las proteínas modelo podría ser aplicable a la proteína que causa el glaucoma.
"Los primeros estudios demostraron que probablemente era similar a estas proteínas modelo que forman amiloide", dice Lieberman. "Quería investigar eso porque si podíamos demostrar que era cierto, entonces podríamos aprovechar los increíbles recursos e investigaciones realizadas en sistemas modelo para ayudarnos a combatir la enfermedad".
"Esta fue una de las proteínas formadoras de amiloide más grandes caracterizadas hasta la fecha", dice Saccuzzo, y aunque el equipo esperaba encontrar similitudes con las proteínas modelo, la proteína más grande asociada al glaucoma mostró una mayor complejidad.
"Creo que una de las observaciones más sorprendentes que hicimos es que la proteína en sí no está en equilibrio durante unos 90 días después de su formación", añade Lieberman. "Uno de los principios de la química de las proteínas es que las secuencias de aminoácidos adoptan una estructura única y que toda la información necesaria para plegar la proteína en su estructura 3D se mantiene en esa secuencia de aminoácidos".
Aquí, la proteína se movía una pequeña cantidad, lo que significa que no estaba en equilibrio. "Están sucediendo muchas más cosas en el sistema de las que cualquiera podría haber imaginado", explica Lieberman. "Suponemos que la forma controla algunas de las propiedades, pero éste es otro misterio de esta proteína."
Debido a que la proteína es tan complicada y no está en equilibrio, "hay una larga lista de cosas que no podemos predecir", dice Lieberman, y agrega que dificulta las predicciones por computadora, junto con ciertos experimentos. "Ese fue un momento en el que pensamos:vaya, aquí tenemos este nuevo sistema en el que la gente debería pensar. Las reglas podrían perfeccionarse para ayudarnos a comprender mejor lo que está pasando".
Si bien será necesario realizar más investigaciones para determinar cuál es la mejor manera de tratar el glaucoma, el estudio proporciona una base fundamental para estudios futuros. "Lo que no me queda claro ahora es si podríamos encontrar un fármaco para todas las personas que tienen mutaciones, o si necesitamos un fármaco específico para cada tipo de mutación que encontremos", afirma Lieberman. P>
Si bien la investigación no prueba que un tratamiento pueda no ser efectivo para todos, "ciertamente muestra que este sistema implica mucho más de lo que esperábamos".
"Comprender cómo se ven las enfermedades mutantes a nivel molecular podría ayudar a allanar el camino para terapias y herramientas de diagnóstico para el glaucoma estructuralmente específicas", añade Saccuzzo.
Lieberman y Saccuzzo también subrayan que el trabajo realizado para comprender la proteína responsable del glaucoma también se puede aplicar a otras proteínas de gran tamaño.
"Al final del día, hay más proteínas que no son proteínas modelo que proteínas modelo", dice Lieberman.
"Existen muchos más sistemas y sospecho que hay muchas más proteínas que pueden agregarse y contribuir a enfermedades o envejecimiento que aún no se han explorado. Creo que esta investigación muestra el valor de aportar muchos enfoques diferentes para investigar un sistema complicado para aprender más sobre él."
Más información: Emily G. Saccuzzo et al, Competencia entre el desarrollo de adentro hacia afuera y la agregación patógena en una hélice β formadora de amiloide, Nature Communications (2024). DOI:10.1038/s41467-023-44479-2
Información de la revista: Comunicaciones sobre la naturaleza
Proporcionado por el Instituto de Tecnología de Georgia