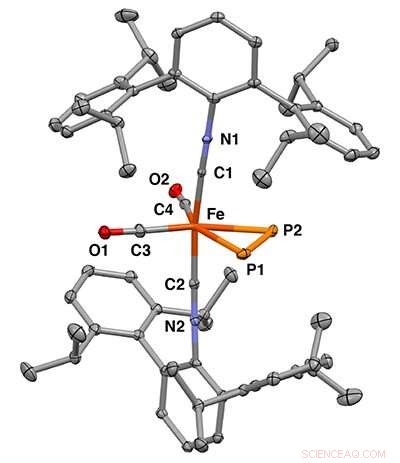
Estructura cristalina de rayos X del complejo mononuclear de hierro η2-difósforo. Crédito:Figueroa Lab Group, UC San Diego / Curtis Moore, Universidad Estatal de Ohio
Los elementos de la tabla periódica de elementos se enumeran de manera que enfatizan ciertas relaciones. Hay familias, períodos (las filas horizontales) y grupos (las columnas verticales). Los elementos dentro de cada uno de estos grupos exhiben algunos puntos en común.
Las relaciones diagonales en la tabla periódica existen entre dos elementos en posiciones diagonales entre sí que exhiben propiedades químicas similares. El litio y el magnesio, el boro y el silicio, y el carbono y el fósforo son ejemplos.
Durante mucho tiempo se ha reconocido una relación diagonal icónica entre el carbono y el fósforo, especialmente en los casos en los que están presentes múltiples enlaces elemento-elemento, como el difósforo (P2 ) en el que dos átomos de fósforo están unidos por un triple enlace débil.
Esta relación diagonal entre el fósforo y el carbono ha creado la expectativa de que la molécula de difósforo imite los atributos del hidrocarburo acetileno (C2 H2 ). Por ejemplo, tanto el difósforo como el acetileno reaccionan con otras moléculas orgánicas a través de sus enlaces pi, un tipo de enlace covalente que se encuentra en moléculas con enlaces múltiples.
Un complejo de coordinación consta de un átomo o ión central que suele ser metálico y está rodeado de moléculas o iones unidos, conocidos como ligandos o agentes complejantes. Los complejos de coordinación son vitales para la vida en la tierra e incluyen la hemoglobina y la clorofila. También se utilizan ampliamente en aplicaciones industriales como catalizadores.
Aunque el acetileno tiene una química de coordinación bien documentada con metales de transición únicos, los complejos de coordinación que contienen difósforo unido a un único centro metálico siguen siendo esquivos.
Recientemente, investigadores de la Universidad de California en San Diego, la Universidad de Rochester y la Universidad Estatal de Ohio informaron que el difósforo se une a un solo centro metálico. Este trabajo aparece en la edición del 25 de marzo de Science .
El difósforo, a diferencia del acetileno, es altamente inestable y reactivo. Cuando se genera en forma libre, el difósforo se polimeriza rápidamente o reacciona con las moléculas de sustrato que están presentes. En otras palabras, el difósforo no permanece por mucho tiempo, su naturaleza es combinarse con otros elementos y moléculas. Esto hace que sea difícil de estudiar o manipular.
Se han establecido varias rutas sintéticas para formar complejos multinucleares de difósforo. El método más popular es separando el tetraédrico P4 molécula, más comúnmente conocida como fósforo blanco. Sin embargo, el fósforo blanco es tóxico y altamente inflamable (fue un componente principal en muchas bombas incendiarias utilizadas en la Segunda Guerra Mundial).
"El trabajo presentado aquí proporciona una estrategia sintética para acceder a complejos mononucleares de difósforo en entornos de laboratorio", afirmó el profesor de química y bioquímica de UC San Diego, Joshua Figueroa, investigador principal y coautor del artículo. "Anticipamos que este modo de coordinación puede permitir aún más el desarrollo de reacciones selectivas de transferencia de átomos de fósforo a moléculas orgánicas".
Al diseñar el experimento, Figueroa y el becario postdoctoral de UC San Diego, Shuai Wang, utilizaron hierro como ion metálico porque proporcionó una buena plataforma de coordinación que permitió la unión de moléculas pequeñas de manera eficiente. Al unir el difósforo a un ion de hierro, pudieron unir los dos átomos de fósforo de una manera que evitaba la liberación libre de difósforo, lo que proporcionaba la estabilidad buscada.
Wang, quien es el primer autor del artículo y realizó el trabajo sintético, dijo:"Teniendo en cuenta la extrema sensibilidad de la molécula de difósforo libre como una especie fugaz, es notable lo estable que se vuelve al coordinarse con el centro de hierro mononuclear estéricamente gravado. "
Los investigadores utilizaron la cristalografía de rayos X para determinar la estructura tridimensional precisa de las moléculas y la espectroscopia de Mossbauer para observar los cambios en las interacciones de enlace entre el ion de hierro y el difósforo. Esta fue una técnica clave porque permitió a los investigadores demostrar que el difósforo y una molécula de acetileno influyeron en las propiedades del centro de hierro de manera similar.
Si el difósforo puede existir en una forma que sea relativamente estable y selectivamente reactiva, los científicos podrán unirlo a sustratos en algo conocido como química de "clic". La química de clic no describe una reacción única y específica, sino que describe una forma de generar sustancias uniendo pequeñas unidades modulares. Esto puede abrir nuevas áreas de descubrimiento en química sintética para la preparación de compuestos farmacéuticos.
"Estamos entusiasmados con este trabajo porque demuestra la importancia de utilizar los conceptos fundamentales aprendidos en el primer año de química para guiar nuevos descubrimientos", dijo Figueroa. Nuevo ion aromático inorgánico