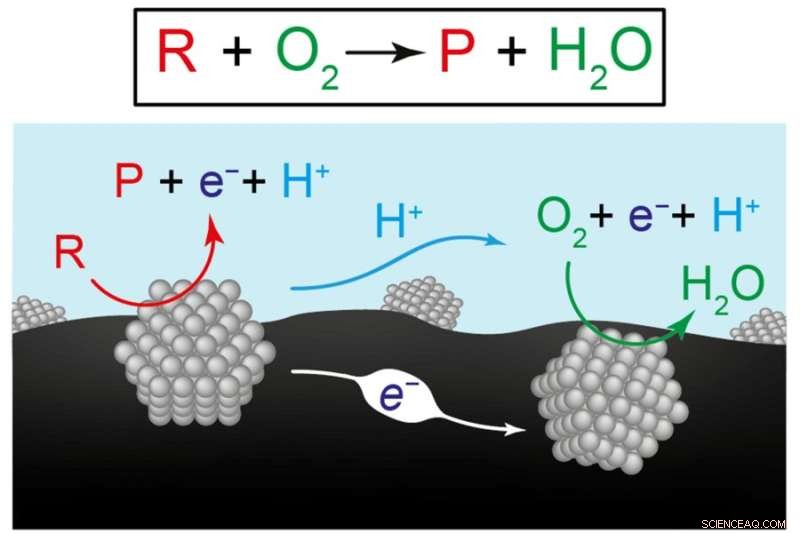
Esta figura presenta dos vistas de las reacciones químicas para producir combustibles y productos químicos renovables. La ecuación superior representa la conversión del reactivo (R) más oxígeno (O2) a un producto (P) más agua (H2O). El siguiente diagrama ilustra la hipótesis de los investigadores de que la reacción general es el resultado de dos semirreacciones coordinadas que ocurren en materiales catalizadores separados, aquí representados por estructuras grises. En el catalizador de la izquierda, el reactivo se convierte en un producto, enviando electrones (e-) al material de soporte de carbono (negro) y protones (H+) al agua (azul). En el catalizador de la derecha, los electrones y protones se consumen a medida que impulsan la reacción del oxígeno al agua. Crédito:Imagen cortesía de los investigadores.
Un desafío en la descarbonización del sistema energético es saber cómo lidiar con nuevos tipos de combustibles. Los combustibles tradicionales, como el gas natural y el petróleo, pueden combinarse con otros materiales y luego calentarse a altas temperaturas para que reaccionen químicamente y produzcan otros combustibles o sustancias útiles, o incluso energía para realizar trabajo. Pero los nuevos materiales, como los biocombustibles, no pueden soportar tanto calor sin descomponerse.
Un ingrediente clave en tales reacciones químicas es un catalizador sólido especialmente diseñado que se agrega para estimular la reacción pero que no se consume en el proceso. Con los materiales tradicionales, el catalizador sólido normalmente interactúa con un gas; pero con combustibles derivados de biomasa, por ejemplo, el catalizador debe trabajar con un líquido, un desafío especial para quienes diseñan catalizadores.
Durante casi una década, Yogesh Surendranath, profesor asociado de química en el MIT, se ha centrado en las reacciones químicas entre catalizadores sólidos y líquidos, pero en una situación diferente:en lugar de utilizar calor para impulsar las reacciones, él y su equipo obtienen electricidad de un batería o una fuente renovable como la eólica o la solar para dar a las moléculas químicamente inactivas más energía para que reaccionen. Y la clave de su investigación es diseñar y fabricar catalizadores sólidos que funcionen bien para reacciones que involucran líquidos.
Al reconocer la necesidad de usar biomasa para desarrollar combustibles líquidos sostenibles, Surendranath se preguntó si él y su equipo podrían tomar los principios que aprendieron sobre el diseño de catalizadores para impulsar reacciones líquido-sólido con electricidad y aplicarlos a las reacciones que ocurren en las interfaces líquido-sólido sin cualquier aporte de electricidad.
Para su sorpresa, encontraron que su conocimiento es directamente relevante. ¿Por qué? "Lo que encontramos, sorprendentemente, es que incluso cuando no conectas los cables a tu catalizador, hay pequeños 'cables' internos que hacen la reacción", dice Surendranath. "Entonces, las reacciones que la gente generalmente piensa que operan sin ningún flujo de corriente en realidad implican que los electrones se trasladen de un lugar a otro". Y eso significa que Surendranath y su equipo pueden aplicar las poderosas técnicas de la electroquímica al problema del diseño de catalizadores para combustibles sostenibles.
Una hipótesis novedosa
Su trabajo se ha centrado en una clase de reacciones químicas importantes en la transición energética que implican la adición de oxígeno a moléculas orgánicas pequeñas (que contienen carbono) como el etanol, el metanol y el ácido fórmico. La suposición convencional es que el reactivo y el oxígeno reaccionan químicamente para formar el producto más agua. Y un catalizador sólido, a menudo una combinación de metales, está presente para proporcionar sitios en los que el reactivo y el oxígeno pueden interactuar.
Pero Surendranath propuso una visión diferente de lo que está pasando. En la configuración habitual, dos catalizadores, cada uno compuesto por muchas nanopartículas, se montan sobre un sustrato de carbono conductor y se sumergen en agua. En ese arreglo, los electrones cargados negativamente pueden fluir fácilmente a través del carbono, mientras que los protones cargados positivamente pueden fluir fácilmente a través del agua.
La hipótesis de Surendranath era que la conversión de reactivo en producto progresa por medio de dos "medias reacciones" separadas en los dos catalizadores. En un catalizador, el reactivo se convierte en un producto, y en el proceso envía electrones al sustrato de carbono y protones al agua. Esos electrones y protones son recogidos por el otro catalizador, donde impulsan la conversión de oxígeno en agua. Entonces, en lugar de una sola reacción, dos semirreacciones separadas pero coordinadas juntas logran la conversión neta de reactivo a producto.
Como resultado, la reacción general en realidad no implica ninguna producción o consumo neto de electrones. Es una reacción "térmica" estándar que resulta de la energía en las moléculas y tal vez algo de calor agregado. El enfoque convencional para diseñar un catalizador para tal reacción se centraría en aumentar la tasa de conversión de reactivo a producto. Y el mejor catalizador para ese tipo de reacción podría ser, por ejemplo, oro, paladio o algún otro metal precioso caro.
Sin embargo, si esa reacción en realidad involucra dos semirreacciones, como propuso Surendranath, hay un flujo de carga eléctrica (los electrones y los protones) entre ellas. Entonces, Surendranath y otros en el campo podrían usar técnicas de electroquímica para diseñar no un solo catalizador para la reacción general, sino dos catalizadores separados:uno para acelerar una media reacción y otro para acelerar la otra media reacción. "Eso significa que no tenemos que diseñar un catalizador para hacer todo el trabajo pesado de acelerar toda la reacción", dice Surendranath. "Podríamos emparejar dos catalizadores abundantes en tierra de bajo costo, cada uno de los cuales hace bien la mitad de la reacción, y juntos llevan a cabo la transformación general de manera rápida y eficiente".
Pero hay una consideración más:los electrones pueden fluir a través de todo el compuesto del catalizador, que abarca la(s) partícula(s) del catalizador y el sustrato de carbono. Para que la conversión química ocurra lo más rápido posible, la velocidad a la que se colocan los electrones en el compuesto del catalizador debe coincidir exactamente con la velocidad a la que se extraen. Centrándonos solo en los electrones, si la conversión de reacción en producto en el primer catalizador envía la misma cantidad de electrones por segundo al "baño de electrones" en el compuesto del catalizador que la conversión de oxígeno en agua en el segundo catalizador. fuera, las dos semirreacciones se equilibrarán y el flujo de electrones y la velocidad de la reacción combinada serán rápidos. El truco consiste en encontrar buenos catalizadores para cada una de las semirreacciones que coincidan perfectamente en términos de electrones que entran y salen.
"Un buen catalizador o un par de catalizadores pueden mantener un potencial eléctrico, esencialmente un voltaje, en el que ambas semirreacciones son rápidas y equilibradas", dice Jaeyune Ryu Ph.D. '21, ex miembro del laboratorio Surendranath y autor principal del estudio; Ryu es ahora un postdoctorado en la Universidad de Harvard. "Las velocidades de las reacciones son iguales y el voltaje en el compuesto del catalizador no cambiará durante la reacción térmica general".
Dibujo en electroquímica
Sobre la base de su nueva comprensión, Surendranath, Ryu y sus colegas recurrieron a las técnicas electroquímicas para identificar un buen catalizador para cada semirreacción que también se combinaría para funcionar bien en conjunto. Su marco analítico para guiar el desarrollo de catalizadores para sistemas que combinan dos semirreacciones se basa en una teoría que se ha utilizado para comprender la corrosión durante casi 100 años, pero que rara vez se ha aplicado para comprender o diseñar catalizadores para reacciones que involucran moléculas pequeñas importantes para la transición energética.
La clave de su trabajo es un potenciostato, un tipo de voltímetro que puede medir pasivamente el voltaje de un sistema o cambiarlo activamente para provocar una reacción. En sus experimentos, Surendranath y su equipo usan el potenciostato para medir el voltaje del catalizador en tiempo real, monitoreando cómo cambia de milisegundo a milisegundo. Luego correlacionan esas mediciones de voltaje con mediciones simultáneas pero separadas de la tasa general de catálisis para comprender la vía de reacción.
Para su estudio de la conversión de moléculas pequeñas relacionadas con la energía, primero probaron una serie de catalizadores para encontrar buenos para cada semirreacción:uno para convertir el reactivo en producto, produciendo electrones y protones, y otro para convertir el oxígeno. al agua, consumiendo electrones y protones. En cada caso, un candidato prometedor produciría una reacción rápida, es decir, un flujo rápido de electrones y protones hacia afuera o hacia adentro.
Para ayudar a identificar un catalizador efectivo para realizar la primera media reacción, los investigadores usaron su potenciostato para ingresar voltajes cuidadosamente controlados y midieron la corriente resultante que fluyó a través del catalizador. Un buen catalizador generará mucha corriente con poco voltaje aplicado; un catalizador deficiente requerirá un alto voltaje aplicado para obtener la misma cantidad de corriente. Luego, el equipo siguió el mismo procedimiento para identificar un buen catalizador para la segunda mitad de la reacción.
Para acelerar la reacción general, los investigadores necesitaban encontrar dos catalizadores que coincidieran bien, donde la cantidad de corriente a un voltaje aplicado dado fuera alta para cada uno de ellos, asegurando que mientras uno producía un flujo rápido de electrones y protones, el otro los consumió al mismo ritmo.
Para probar pares prometedores, los investigadores usaron el potenciostato para medir el voltaje del compuesto catalizador durante la catálisis neta, sin cambiar el voltaje como antes, pero ahora solo midiéndolo a partir de muestras diminutas. En cada prueba, el voltaje se establecerá naturalmente en un cierto nivel, y el objetivo es que eso suceda cuando la velocidad de ambas reacciones sea alta.
Validando su hipótesis y mirando hacia el futuro
Al probar las dos semirreacciones, los investigadores pudieron medir cómo variaba la velocidad de reacción de cada una con los cambios en el voltaje aplicado. A partir de esas medidas, pudieron predecir el voltaje al que la reacción completa procedería más rápido. Las mediciones de la reacción completa coincidieron con sus predicciones, lo que respalda su hipótesis.
El enfoque novedoso del equipo de usar técnicas electroquímicas para examinar reacciones que se cree que son de naturaleza estrictamente térmica proporciona nuevos conocimientos sobre los pasos detallados mediante los cuales ocurren esas reacciones y, por lo tanto, sobre cómo diseñar catalizadores para acelerarlas. "Ahora podemos usar una estrategia de divide y vencerás", dice Ryu. "Sabemos que la reacción térmica neta en nuestro estudio ocurre a través de dos semirreacciones 'ocultas' pero acopladas, por lo que podemos apuntar a optimizar una semirreacción a la vez", posiblemente utilizando materiales catalizadores de bajo costo para uno o ambos.
Surendranath agrega:"Una de las cosas que nos emociona de este estudio es que el resultado no es definitivo en sí mismo. Realmente ha sembrado un área de empuje completamente nueva en nuestro programa de investigación, que incluye nuevas formas de diseñar catalizadores para la producción y transformación de combustibles renovables y químicos”.
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre investigación, innovación y enseñanza del MIT. El catalizador económico y ecológico abre nuevas posibilidades para las moléculas orgánicas construidas a partir del piruvato