Gráficamente abstracto. Crédito:Revista de la Sociedad Química Estadounidense (2022). DOI:10.1021/jacs.1c12407
Investigadores de la Universidad de East Anglia han identificado una nueva clase de enzima involucrada en el manejo del estrés en bacterias.
Todos los organismos, desde los humanos hasta las bacterias, deben ser capaces de responder a una amplia gama de tensiones que resultan de los cambios en su entorno.
Son comunes entre ellos los llamados estrés oxidativo y nitrosativo, que se producen cuando un organismo se expone a altas concentraciones de oxígeno de reacción o especies de nitrógeno reactivo, respectivamente. Cuando esto sucede, los componentes frágiles de la célula se dañan, lo que lleva a la pérdida de la función y, en algunos casos, a la muerte celular.
Como era de esperar, los organismos han desarrollado una multitud de sistemas de respuesta al estrés que detectan y alivian las tensiones particulares.
Los grupos de hierro y azufre, que consisten en hierro y azufre inorgánico, se encuentran en todos los tipos de células, donde desempeñan funciones esenciales en una amplia gama de procesos celulares. Debido a que son tan reactivos, a menudo son los primeros componentes celulares que se dañan en condiciones de estrés.
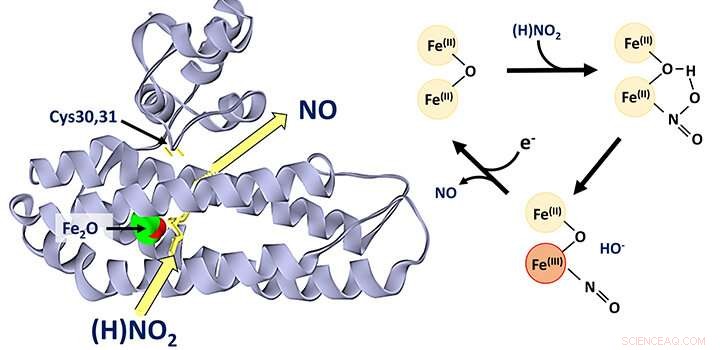
En general, se cree que la proteína de dihierro YtfE, que se encuentra ampliamente en las bacterias, funciona directamente en la reparación de grupos de hierro y azufre que han sido dañados bajo condiciones de estrés. Esta actividad se ha propuesto de forma variable para involucrar la donación de hierro para la reconstrucción de grupos de hierro y azufre, o la eliminación de óxido nítrico (NO) de grupos dañados.
Recientemente, nueva evidencia salió a la luz a partir de estudios de la función de YtfE en células que sugirieron que su actividad está asociada con un aumento, y no con una disminución, en la concentración de NO. Esto llevó a los investigadores de la Facultad de Química a volver a examinar la función de YtfE.
El equipo, dirigido por el Dr. Jason Crack y el Prof. Nick Le Brun, y en el que participaron el laboratorio del Dr. Fraser MacMillan, así como investigadores de la Universidad de Birmingham y la Universidad de Sheffield, descubrió que YtfE es un nuevo tipo de enzima nitrito reductasa que produce NO.
Demostraron que YtfE no elimina eficientemente el NO de los cúmulos de hierro y azufre dañados, ni es un donante efectivo de hierro para el ensamblaje de cúmulos.
La producción catalizada por YtfE de NO tóxico a partir de nitrito (NO2 - ) puede parecer extraño, pero YtfE está co-regulado con otra enzima, llamada Hcp, que funciona para desintoxicar el NO (a través de su reducción a óxido nitroso, N2 O).
La vía de desintoxicación YtfE/Hcp acoplada representa un medio eficaz por el cual la célula trata con los niveles tóxicos de nitrito que pueden ocurrir en condiciones anaeróbicas.
El equipo utilizó una variedad de enfoques, incluida la espectroscopia de proteínas genética in vivo e in vitro y la espectrometría de masas, para obtener información detallada sobre el mecanismo por el cual YtfE genera NO a partir de nitrito.
El trabajo aclara el papel de una proteína que ha desconcertado a los investigadores durante mucho tiempo, demostrando que YtfE es un actor clave para el manejo del estrés en condiciones de respiración anaeróbica, como las que se encuentran en el intestino humano o cuando infectan a un huésped humano.
El trabajo se publica esta semana en el Journal of the American Chemical Society . Los investigadores sugieren que los grupos [FeS] actúan como fusibles biológicos en muchas proteínas involucradas en la respuesta inmune