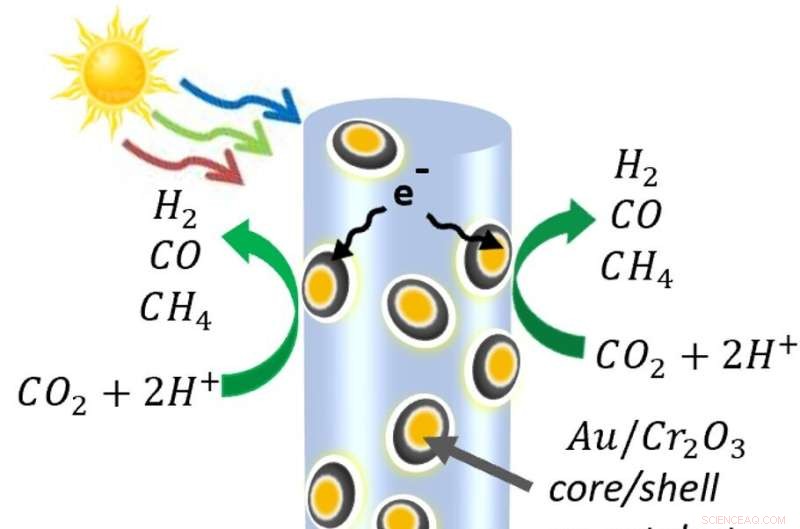
Un diagrama de los nanocables semiconductores hechos de indio, galio y nitrógeno, decorados con nanopartículas de óxido de cromo y oro. Cuando la luz golpea el nanocable, libera electrones y los "agujeros" cargados positivamente que los electrones dejan atrás. En el propio nanocable, los agujeros oxidan el agua en protones (hidrógeno) y oxígeno. Mientras tanto, algunos electrones son atraídos hacia las nanopartículas metálicas, donde descomponen el dióxido de carbono. Las moléculas se recombinan en las moléculas de monóxido de carbono, hidrógeno y metano que forman el gas de síntesis. Crédito:Roksana Rashid, Universidad McGill.
El gas de síntesis alimentado por energía solar podría reciclar el dióxido de carbono en combustibles y productos químicos útiles, según ha demostrado un equipo internacional de investigadores.
"Si podemos generar gas de síntesis a partir de dióxido de carbono utilizando solo energía solar, podemos usarlo como precursor del metanol y otros productos químicos y combustibles. Esto reducirá significativamente el CO2 general. emisiones", dijo Zetian Mi, profesor de ingeniería eléctrica e informática en la Universidad de Michigan, quien dirigió el estudio publicado en Proceedings of the National Academy of Science .
Compuesto principalmente de hidrógeno y monóxido de carbono con un poco de metano, el gas de síntesis comúnmente se deriva de combustibles fósiles con la ayuda de la electricidad. Además, a menudo se agregan productos químicos tóxicos para que el proceso sea más eficiente.
"Nuestro nuevo proceso en realidad es bastante simple, pero es emocionante porque no es tóxico, es sostenible y muy rentable", dijo Roksana Rashid, primera autora del estudio, quien realizó los experimentos como estudiante de doctorado en ingeniería eléctrica e informática en la Universidad McGill en Canadá.
Para crear un proceso que utilice únicamente energía solar, el grupo de Mi superó la dificultad de dividir las moléculas de dióxido de carbono, que se encuentran entre las más estables del universo. Para ello, salpicaron un bosque de nanocables semiconductores con nanopartículas. Esas nanopartículas, hechas de oro recubiertas con óxido de cromo, atrajeron las moléculas de dióxido de carbono y las doblaron, debilitando los enlaces entre el carbono y el oxígeno.
Los nanocables de nitruro de galio utilizaron la energía de la luz para liberar electrones y los espacios cargados positivamente que dejan atrás, conocidos como agujeros. Los agujeros dividen las moléculas de agua, separando los protones (hidrógeno) del oxígeno. Luego, en los catalizadores metálicos, los electrones dividen el dióxido de carbono, produciendo monóxido de carbono y, a veces, extrayendo el hidrógeno libre para producir metano. Se están desarrollando procesos para separar el oxígeno de los demás gases.
"Nuestra tecnología arroja luz sobre cómo construir una producción distribuida de gas de síntesis a partir del aire, el agua y la luz solar", dijo Baowen Zhou, coautor correspondiente del estudio con Mi y ex investigador postdoctoral en el laboratorio de Mi en la Universidad McGill y la U-M.
Al cambiar la proporción de oro a óxido de cromo en las nanopartículas, el equipo de Mi pudo controlar las cantidades relativas de hidrógeno y monóxido de carbono producidas en la reacción. Esto es importante porque la proporción de hidrógeno a monóxido de carbono afecta la facilidad con la que se produce un tipo de combustible o producto químico.
"Lo que sorprende es la sinergia entre el oro y el óxido de cromo para hacer que el CO2 reducción a syngas eficiente y sintonizable. Eso no era posible con un solo catalizador de metal", dijo Mi. "Esto abre muchas oportunidades emocionantes que no se habían considerado anteriormente".
La configuración de gas de síntesis sintonizable de Mi utiliza procesos de fabricación industrial estándar y es escalable. Si bien Rashid usó agua destilada en este experimento, también se espera que funcionen el agua de mar y otras soluciones de electrolitos, y Mi las ha usado en estudios relacionados con la división del agua.
"El semiconductor que usamos como absorbente de luz se basa en silicio y nitruro de galio, que son los semiconductores más comúnmente producidos, y usamos muy poco material para el nitruro de galio. Cada nanocable tiene un grosor de aproximadamente un micrómetro", dijo Mi.
El próximo objetivo de Mi es aumentar la eficiencia del dispositivo, que actualmente se sitúa en un 0,89%. Cuando el 10% de la energía de la luz se convierte en energía química, espera que la tecnología pueda ser adoptada para energía renovable, similar a las células solares. El 'metano verde' de la fotosíntesis artificial podría reciclar el CO2