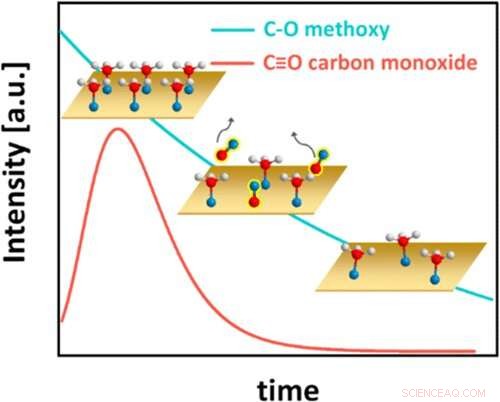
Gráficamente abstracto. Crédito:Catálisis ACS (2022). DOI:10.1021/acscatal.1c05933
Investigadores del Instituto de Ciencias Weizmann y el Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) han investigado la dinámica a nivel molecular en juego cuando el metanol se convierte en hidrógeno mediante la ayuda de un catalizador de cobre, con todo el sistema bajo presión y temperatura ambiente. . Este estudio, que arrojó información sorprendente sobre el comportamiento del metanol en diferentes superficies de cobre, ayudará a los investigadores a encontrar el catalizador de cobre de mejor rendimiento para este proceso y, en términos más generales, a ampliar su comprensión de los catalizadores de cobre como grupo.
El metanol (un compuesto de hidrógeno, carbono y oxígeno) es un material versátil en la industria energética. Puede usarse como combustible en sí mismo o, como en esta investigación, para producir otro combustible:hidrógeno. El metanol es un candidato líder para las tecnologías de almacenamiento de hidrógeno, particularmente en aplicaciones de celdas de combustible para automóviles. Un líquido a temperatura ambiente, es fácil de trabajar y compatible con la infraestructura de gasolina existente. También contiene una cantidad relativamente grande de hidrógeno por volumen. Pero para producir hidrógeno de manera eficiente, el metanol requiere la ayuda de un catalizador, así como una temperatura relativamente alta.
En este estudio, descrito en la edición en línea del 14 de junio de 2022 de ACS Catalysis , los investigadores de Weizmann y Brookhaven estudiaron un sistema de metanol/cobre (metanol ligado al vapor o "adsorbido" sobre una superficie de cobre) que no requería una temperatura alta. Se centraron en la "descomposición del metanol", la más simple de las cuatro reacciones que pueden producir hidrógeno a partir del metanol. Entre los posibles catalizadores de la reacción, los basados en cobre (Cu) se consideran los más prometedores. Esto se debe a varios factores, incluida su estructura electrónica favorable para la actividad catalítica y su relativo bajo costo y seguridad ambiental en comparación con otros metales. Para comprender mejor el papel del Cu, es esencial que los científicos adquieran un conocimiento profundo a nivel molecular de la interacción entre el vapor de metanol y las superficies de Cu.
Investigadores de Weizmann y el Centro de Nanomateriales Funcionales (CFN), una instalación para usuarios de la Oficina de Ciencias del DOE en Brookhaven, observaron tres superficies de Cu para saber cómo se adhirió el metanol a ellas y cómo se comportó. Estas tres geometrías superficiales se investigan comúnmente como catalizadores debido a la forma en que se organizan los átomos de Cu, lo que los hace más disponibles para interactuar electrónicamente con otros compuestos. El grupo descubrió que el metanol actúa de formas inesperadas en las tres superficies.
"La tendencia que vimos en las tres superficies fue que una gran cantidad de metanol se adsorbió al principio, luego se dividió en diferentes componentes que se desorbieron. Después de un tiempo, la cobertura de metanol alcanzó un punto de equilibrio", dijo Ashley Head, investigadora de Interface. Grupo de Ciencias/Catálisis del CFN y uno de los autores del artículo. "No habíamos visto este comportamiento antes y no esperábamos verlo".
Para estudiar la dinámica de esto, el grupo utilizó técnicas de espectroscopía tanto infrarroja (IR) como de rayos X, esta última realizada en el CFN.
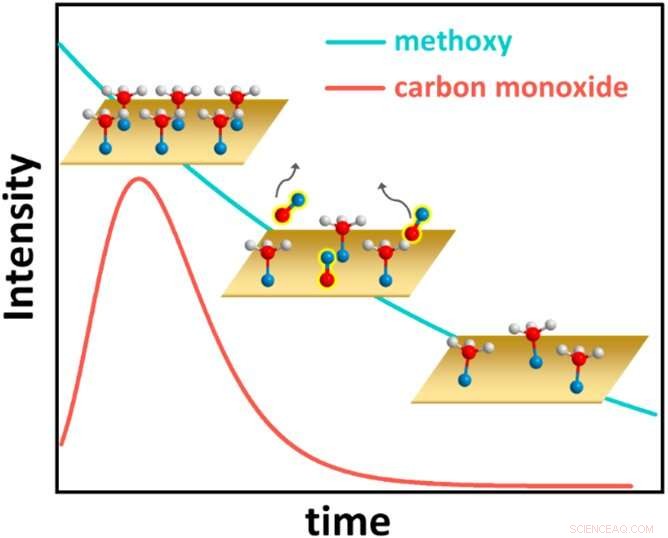
Esta figura representa el sorprendente comportamiento cinético del sistema metanol sobre cobre, con los átomos de hidrógeno representados como esferas blancas, los átomos de oxígeno como esferas azules y los átomos de carbono como esferas rojas. Inicialmente, el metanol cubre por completo la superficie de cobre (Cu) (gráfico superior izquierdo). Cada molécula de metanol luego pierde un átomo de hidrógeno y forma un enlace químico con el Cu, convirtiéndose en una especie de carbono-oxígeno conocida como metoxi. El metoxi de la superficie, a su vez, reacciona para formar monóxido de carbono (CO), que se desorbe de la superficie (gráfico central, con la cobertura de CO a lo largo del tiempo representada por la línea roja). Luego, la cobertura de metoxi disminuye constantemente (gráfico inferior derecho y línea azul). Eventualmente, se alcanza una cobertura metoxi de equilibrio (no mostrada). Crédito:Laboratorio Nacional de Brookhaven
El trabajo de IR, realizado en Weizmann, brindó información sobre qué especies químicas de metanol se formaron en la superficie de Cu midiendo cómo vibran las moléculas. Las vibraciones específicas se pueden vincular a compuestos específicos.
Los datos de IR indicaron que el metanol se adsorbió fuertemente en el cobre y formó un enlace directo con el Cu, formando un componente químico conocido como metoxi. La cobertura de metoxi luego disminuyó gradualmente. Este comportamiento se observó en las tres superficies, con variaciones menores.
"Esta dinámica no concuerda con lo que los modelos bien establecidos de este sistema nos dicen que deberíamos ver", dijo Baran Eren, investigador del Departamento de Física Química y Biológica de Weizmann y autor correspondiente del artículo. "En cambio, la evolución de la cobertura de metoxi con el tiempo sigue un modelo cinético de adsorción extraordinario".
Continuó:"Proponemos que una forma de vida corta de metanol unido a hidrógeno sea la fuente de la densa capa de metoxi inicial".
La información obtenida de los datos IR se confirmó en CFN, donde el grupo utilizó espectroscopía de fotoelectrones de rayos X (APXPS). En esta técnica, los rayos X energizan los electrones de una muestra, haciendo que se liberen. Esos electrones expulsados llevan información valiosa. En este caso, proporcionaron información adicional sobre el comportamiento del metanol en la superficie de Cu y las condiciones circundantes en tiempo real. APXPS permite a los investigadores calcular más fácilmente las coberturas de moléculas en superficies que la espectroscopia IR.
Con el paso del tiempo, el exceso de metoxi se eliminó a medida que se producía más y más hidrógeno, dejando monóxido de carbono que se desasorbía del cobre como gas. El metoxi que quedó alcanzó un punto de cobertura uniforme, un punto de equilibrio. En particular, la cinética de este proceso fue considerablemente más rápida en la superficie de Cu más suelta en comparación con las otras dos, que están más densamente empaquetadas.
En el trabajo futuro, el grupo planea continuar estudiando los sistemas de metanol/Cu para aprender más sobre su dinámica y si algunos de estos comportamientos podrían encontrarse en sistemas distintos al metanol en Cu. Sorprendido en el acto:identificados intermediarios químicos clave en la reacción de contaminante a combustible