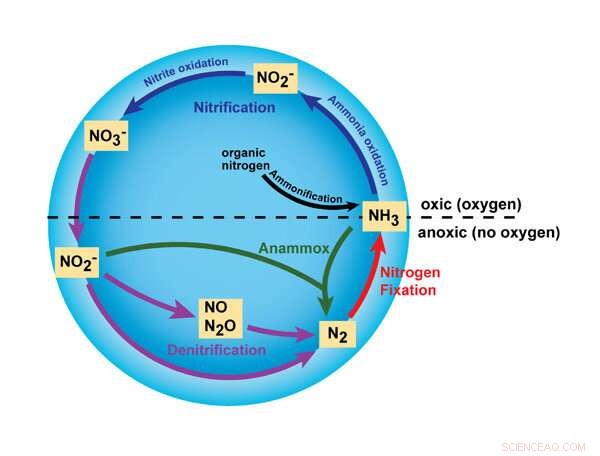
Este gráfico destaca algunas de las principales reacciones en el ciclo del nitrógeno, iniciadas por el uso de amoníaco o NH3 , fertilizantes. La nueva investigación de MSU se enfoca en las reacciones que involucran nitrito (NO2 -), óxido nítrico (NO) y óxido nitroso (N2 O). Copyright:Educación sobre la naturaleza, 2010
Es posible que el nitrógeno no reciba el mismo nivel de atención que sus vecinos en la tabla periódica, el carbono y el oxígeno. Pero al igual que sus vecinos, es un elemento sin el que no podemos vivir.
Los compuestos de nitrógeno tienen funciones importantes en la biología, incluida la reducción de la presión arterial, ayudar a transmitir señales en nuestros cuerpos y proporcionar alimento para las plantas. De hecho, los fertilizantes industriales ricos en nitrógeno han duplicado efectivamente la capacidad mundial de cultivo de alimentos.
Sin embargo, demasiado de cualquier cosa puede ser malo, y el nitrógeno no es una excepción. Por ejemplo, cuando la lluvia arrastra el exceso de fertilizante de los campos a los lagos, ríos y otros cuerpos de agua, los compuestos nutritivos que contienen pueden alimentar poblaciones crecientes de microbios que pueden sofocar o envenenar los ecosistemas naturales.
Los impactos subyacentes del nitrógeno, útiles y dañinos por igual, son lo que se conoce como el ciclo del nitrógeno. Ese es el nombre colectivo de los procesos químicos que utilizan los sistemas biológicos y geológicos de la naturaleza para descomponer los compuestos de nitrógeno y transportar los productos a través del medio ambiente. Aunque la ciencia ha desarrollado gran parte del panorama general del ciclo del nitrógeno, Timothy Warren de la Universidad Estatal de Michigan y su equipo ahora están profundizando en sus detalles químicos fundamentales.
El equipo publicó recientemente dos nuevos informes sobre ese frente en dos revistas de química diferentes:Nature Chemistry y el Diario de la Sociedad Americana de Química (JACS ).
Lo que Warren y su equipo descubrieron recientemente no proporcionará soluciones inmediatas para, por ejemplo, fabricar y usar fertilizantes de una manera más sostenible. Pero los investigadores están creando una comprensión más profunda del ciclo del nitrógeno que podría conducir a soluciones holísticas para garantizar un equilibrio saludable de nitrógeno, donde sea que se necesite.
Mientras tanto, los documentos también sirven como un recordatorio de que la naturaleza todavía está llena de misterios consecuentes, algunos de los cuales son anteriores a las personas y las plantas.
"Estamos muy inspirados por lo que encontramos en la naturaleza, pero estamos tratando de comprender las formas en que se comporta la naturaleza que aún no hemos captado", dijo Warren, profesor de Barnett Rosenberg y presidente del Departamento de Química en la Facultad de Ciencias Naturales.
"Existe el dogma establecido de cómo funcionan las cosas, pero al profundizar un poco más y tratar de ir más allá, abrimos la ciencia a las sorpresas".
Además de descubrir algunas nuevas revelaciones, ambos documentos ayudan a describir el ciclo del nitrógeno con mayor detalle y precisión de lo que era posible anteriormente. Sin embargo, a pesar de sus similitudes, también vienen con diferentes conjuntos de implicaciones.
Química primordial con un 'nitro boost'
A riesgo de simplificar demasiado todo un campo científico, la química se ocupa de cómo se intercambian y reorganizan los átomos cuando están involucrados diferentes participantes moleculares. Algunas de las interacciones más intrigantes son aquellas que son esenciales para la vida, aquellas que mejoran nuestra calidad de vida o aquellas que ayudan a los científicos a comprender mejor cómo funciona la vida en este planeta.
Las reacciones del ciclo del nitrógeno pueden marcar las tres casillas, como lo demuestran las destacadas en los documentos del equipo de Warren.
"Estos dos informes brindan nuevos conocimientos fundamentales sobre las moléculas que son partes importantes del ciclo biogeoquímico del nitrógeno. Ese ciclo es fundamental para que los ecosistemas funcionen y estén saludables", dijo Warren. "Lo que estamos haciendo es observar las moléculas de nuevas formas para comprender mejor su conexión con ese ciclo".
En particular, el artículo JACS del equipo ilumina una nueva vía que la naturaleza puede usar para convertir el óxido nítrico en óxido nitroso, que son moléculas importantes por derecho propio.
El óxido nítrico, formado por un átomo de nitrógeno y un átomo de oxígeno, fue nombrado "Molécula del año" en 1992 por la revista Science. Y la gente puede reconocer el óxido nitroso, que contiene dos átomos de nitrógeno y uno de oxígeno, por su papel protagónico en el gas de la risa o su papel secundario como "nitro boost" en la franquicia de películas "Fast and Furious".
Nuevamente, el equipo de Warren es consciente de las aplicaciones de las moléculas, pero los investigadores están motivados por lo que revelan estas reacciones a un nivel químico más fundamental. El JACS el papel, por ejemplo, revela que el óxido nítrico es sorprendentemente hábil para aceptar electrones de otros reactivos.
En las condiciones adecuadas, el óxido nitroso también puede ser un buen aceptor de electrones, pero el oxígeno proporciona un estándar firme en este campo. Es por eso que los químicos se refieren a estos compuestos aceptores de electrones como oxidantes, oxidantes y agentes oxidantes. Los oxidantes causan la oxidación del metal, pero también son fundamentales para muchas reacciones biológicas e industriales importantes.
Pero el oxígeno no fue un producto fácilmente disponible en la atmósfera de la Tierra hasta que el planeta tuvo un par de miles de millones de años. Fue entonces cuando los primeros microbios comenzaron a emitirlo, y las plantas más tarde siguieron su ejemplo a través de la fotosíntesis.
"La naturaleza estaba haciendo química de oxidación antes del Gran Evento de Oxidación, antes de que comenzara la fotosíntesis", dijo Warren. "Eso significa que tanto el óxido nítrico como los compuestos de nitrógeno relacionados probablemente fueron oxidantes importantes en la vida primordial, antes de que la Tierra tuviera mucho oxígeno.
"Resulta que la naturaleza ha desarrollado enzimas que pueden hacer esa química de oxidación con estos compuestos", dijo. "Este documento proporciona nuevos conocimientos sobre cómo la naturaleza los usa hoy y quizás incluso antes de que el oxígeno fuera abundante".
La historia de una molécula rota
La Química natural del equipo El artículo se centró en una parte diferente del ciclo del nitrógeno, una que comienza con un compuesto conocido como nitrito, una molécula cargada negativamente que consta de un átomo de nitrógeno unido a dos átomos de oxígeno.
El nitrito aparece en muchos lugares, muchos de los cuales reflejan la dualidad del nitrógeno. El nitrito se encuentra en los fertilizantes que ayudan a las plantas a crecer. También está en la escorrentía que contamina los ecosistemas acuáticos.
El nitrito se encuentra naturalmente en niveles saludables en frutas y verduras. Al mismo tiempo, los médicos recomiendan limitar nuestro consumo de carnes procesadas, en las que las sales de nitrito se utilizan como conservantes en niveles comparativamente altos.
Cuando se trata de nitrito, la división entre bendición y carga está ligada a la dosis, pero también a si se metaboliza o se convierte en otros compuestos y cómo se hace. Eso significa que, con una mejor comprensión del ciclo del nitrógeno, la química podría ayudar a mitigar los efectos nocivos del nitrito mediante el desarrollo de enzimas u otras herramientas catalíticas que lo encaminen hacia productos posteriores más beneficiosos. En particular, eso incluye el óxido nítrico, "Molécula del año" de 1992.
Los microbios del suelo tienen enzimas que convierten el nitrito en óxido nítrico en un conjunto altamente coreografiado de interacciones químicas que ocurren al mismo tiempo. El equipo de Warren ha encontrado una manera de dividir ese proceso en un asunto secuencial paso a paso. Encontrar este enfoque sintético para imitar la naturaleza permitirá a los químicos investigar mejor los diferentes aspectos de la reacción.
Esto ayudará a los químicos a ser más deliberados en el diseño de catalizadores que puedan hacer cosas como ayudar a descomponer los nutrientes de los fertilizantes antes de que lleguen a las vías fluviales naturales. También abre aplicaciones más alejadas del papel del nitrógeno en la naturaleza, dijo Warren, como en el almacenamiento a largo plazo de desechos nucleares donde están presentes los nitritos. En su estudio, el equipo también descubrió una nueva química que incluso podría ayudar a mejorar las calificaciones de pregrado.
"En cada curso de química general, ya sea que lo tomes en la MSU o en otro lugar, aprendes que el nitrito es un anión con una carga eléctrica de -1. Pero si accidentalmente se le asigna una carga de -2, hemos encontrado una manera eso demuestra que esto también puede ser correcto", dijo Warren.
"Hemos revelado una nueva molécula fundamental en la naturaleza:el nitrito con una carga de -2. No ha habido mucha discusión al respecto antes, excepto como una especie fugaz en los desechos nucleares o tal vez cuando los estudiantes se equivocan en los exámenes". Los investigadores piden más trabajo para equilibrar el ciclo del nitrógeno