Crédito:Universidad de Oregon
Los científicos han sabido durante décadas que cierta clase de enzimas es un actor importante en la biología celular porque con frecuencia mutan y se convierten en los principales impulsores del cáncer.
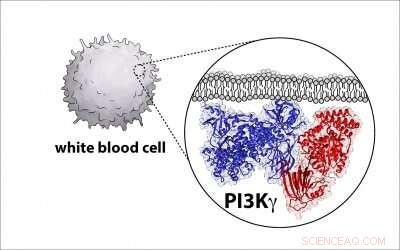
Las empresas biofarmacéuticas están intentando desarrollar fármacos que se dirijan a estas enzimas y las inactiven, conocido como fosfoinositido 3-quinasa, o PI3K para abreviar, debido a su papel como causante de cánceres en humanos. Pero para hacer eso los científicos necesitan un plano detallado de la arquitectura enzimática, y el profesor de bioquímica de la UO, Scott Hansen, es parte de un grupo que descubre ese diagrama.
Hansen, profesor asistente en el Departamento de Química y Bioquímica de la UO, dicha parte del desafío es que las moléculas son complejas, con dos grandes proteínas que se unen y forman un complejo.
"Así que es un verdadero desafío descubrir cuál es la estructura y organización de esta proteína, ", dijo." Un requisito previo para desarrollar un fármaco es aprender cómo se une el fármaco a la molécula. Necesita un plano de la proteína a la que acoplar ese fármaco ".
Ahora, Hansen y sus colegas de varias otras universidades han desarrollado un modelo de este tipo para PI3K e identificado dónde una proteína reguladora crítica se une a la enzima. un hallazgo con potencial para ayudar a impulsar el esfuerzo por fabricar medicamentos contra el cáncer más específicos.
"Esto definitivamente dará forma a la forma en que la gente piensa sobre el desarrollo de terapias contra el cáncer, " él dijo.
Hansen es uno de los 13 coautores del artículo publicado en la revista. Avances de la ciencia , junto con colegas de las universidades de Victoria, Columbia Británica, Washington y Ginebra, y Vrije Universiteit Brussel en Bélgica.
Lo que hace que el artículo sea único es "información estructural de mayor resolución y poder medir interacciones biológicamente relevantes con otras moléculas para definir la secuencia y la prioridad de las interacciones". "Dijo Hansen.
Pero dijo que queda mucho trabajo para comprender mejor cómo otras moléculas se unen a la proteína y modulan su función.
Para conocer la estructura de la enzima, los investigadores utilizaron una técnica llamada microscopía crioelectrónica, que recopila decenas de miles de imágenes de enzimas P13K individuales en una capa ultrafina de hielo utilizando un microscopio electrónico. Las imágenes se compilan y promedian para crear una única imagen de alta resolución que revela las características estructurales de la enzima.
En este caso, la estructura de la enzima era diferente de lo que se pensaba anteriormente. El nuevo plan permitirá a los investigadores definir cómo otras moléculas activan la proteína.
"Muchas veces investigamos y obtenemos pistas sobre cómo se organizan las proteínas o miramos estructuras de moléculas relacionadas y extrapolamos, pero a veces esas suposiciones son inexactas y pueden llevar a un campo por el camino equivocado, "Hansen dijo." Tener un plano de mayor resolución de la organización de moléculas permite a las personas desarrollar fármacos específicos para esa molécula ".
Hansen dijo que los investigadores involucrados en el artículo han pasado 10 años trabajando en el problema.
"Eso no es infrecuente para las proteínas realmente complicadas, " él dijo.
Hansen dijo que su laboratorio en la UO y el laboratorio de John Burke en la Universidad de Columbia Británica realizan investigaciones complementarias. El laboratorio de Burke utiliza microscopía crioelectrónica para obtener imágenes de moléculas de alta resolución, y el laboratorio de Hansen es capaz de "tomar medidas más dinámicas que nos permitan medir las interacciones de esta enzima y otros factores críticos para la activación".
Dijo que es emocionante colaborar con otros científicos que tienen experiencia en áreas que él no tiene.
"Más y más, Para que podamos lograr nuestras ambiciones de investigación, no podemos confiar solo en las habilidades de nuestro propio laboratorio, ", dijo." Los problemas se están volviendo demasiado complicados y hay que abordarlos desde diferentes ángulos e integrar mucha experiencia diferente ".