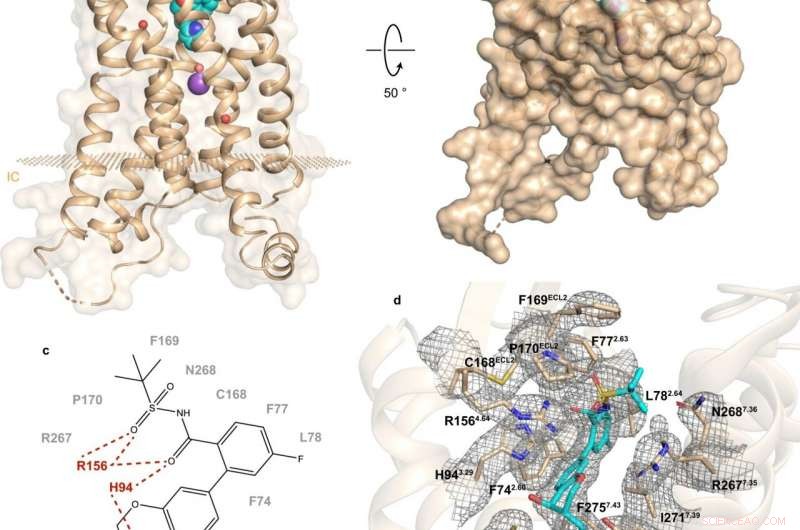
Fig. 1:Estructura y sitio de unión de hBLT1. Crédito:Michaelian, NORTE., et al. Comunicaciones de la naturaleza , https://doi.org/10.1038/s41467-021-23149-1
Investigadores de la Universidad del Sur de California, Merck &Co., Skoltech, MIPT, UCLA, y la Université de Sherbrooke han determinado la estructura del receptor 1 del leucotrieno B4 humano, involucrado en inflamatorio, infeccioso, alérgico, y enfermedades tumorigénicas. Publicado en Comunicaciones de la naturaleza , el análisis de la estructura revela cómo el receptor reconoce a sus compañeros de unión e interactúa con ellos. Esto abre vías para diseñar mejores medicamentos que se dirijan al receptor para tratar la diabetes tipo 2 y otras patologías.
Los receptores son los equipos basados en proteínas que utilizan las células para recibir y transmitir señales. Un receptor se activa cuando se une a una molécula mensajera llamada agonista, después de lo cual transmite la señal, que regula alguna función biológica. Antagonistas, por el contrario, apaga el receptor cuando está atado. Los agonistas y antagonistas se conocen colectivamente como ligandos.
El receptor 1 del leucotrieno B4 humano, o hBLT1, regula los procesos relacionados con la inflamación, como el reclutamiento de células T, así como la proliferación y migración de las células del músculo liso. Ese receptor se ha asociado con enfermedades, incluido el asma, influenza, artritis, aterosclerosis, diabetes, y cáncer.
Desde su descubrimiento en 1997, Ha habido varios intentos de desarrollar ligandos de hBLT1 para su uso como fármacos, pero tuvieron muchos efectos secundarios, baja eficacia, y el cuerpo tardó comparativamente mucho en eliminarlos. Una explicación probable de esto es que los ligandos de hBLT1 usados no son específicos de ese receptor y participan en otras interacciones no deseadas. Aprender más sobre la estructura del receptor y cómo se une a los ligandos puede permitir a los farmacólogos diseñar mejor, fármacos más selectivos.
Un estudio reciente realizado por una colaboración ruso-estadounidense-canadiense arroja luz sobre la composición y el funcionamiento de hBLT1. Vadim Cherezov, profesor de Química en la USC y director del Laboratorio MIPT de Biología Estructural de GPCRs, comentó:"Hemos determinado la estructura cristalina de resolución 2.9-angstrom del receptor hBLT1 en complejo con un antagonista selectivo, MK-D-046, desarrollado por Merck &Co. Esta estructura debería ayudar a diseñar racionalmente mejores terapias para tratar la diabetes tipo 2 y otras condiciones inflamatorias ".
La determinación de la estructura se complementó con estudios de acoplamiento y mutagénesis dirigida al sitio, un método experimental y computacional, respectivamente. Según el profesor asistente de Skoltech, Petr Popov, "Esto hizo posible revelar los determinantes clave de las interacciones intermoleculares entre el receptor y los ligandos".
El análisis de la estructura de hBLT1 revela cómo el receptor reconoce y une ligandos, sugiriendo un canal de acceso de ligando putativo enterrado en la membrana del receptor. Más específicamente, los hallazgos apuntan a las posibles formas en que el receptor podría unirse a sus agonistas endógenos. Es decir, compuestos producidos naturalmente por el cuerpo para unirse a ese receptor y activarlo.
Al mejorar nuestra comprensión de la estructura y el funcionamiento de hBLT1, el estudio abre posibilidades para el diseño de fármacos basados en estructuras.