Crédito:Universidad de Ciencia y Tecnología de Pohang (POSTECH)
Los mejillones sobreviven pegándose a las rocas en las feroces olas o mareas bajo el agua. Los materiales que imitan esta adhesión bajo el agua se utilizan ampliamente para la adhesión a la piel o los huesos. para modificar la superficie de un andamio, o incluso en sistemas de administración de fármacos o células. Sin embargo, estos materiales no han imitado por completo las capacidades de los mejillones.
Un equipo de investigación conjunto de POSTECH y la Universidad Nacional de Kangwon (KNU), dirigido por el profesor Hyung Joon Cha y Ph.D. el candidato Mincheol Shin del Departamento de Ingeniería Química de POSTECH con el Profesor Young Mee Jeong y el Dr. Yeonju Park del Departamento de Química de KNU — ha analizado Dopa y lisina, que son los aminoácidos que componen las proteínas adhesivas superficiales secretadas por los mejillones, y verificó que sus roles estén relacionados con su ubicación. El equipo ha dado un paso más para revelar el secreto de la adhesión bajo el agua al descubrir que estos aminoácidos pueden contribuir a la adhesión y cohesión de la superficie de manera diferente según su ubicación específica.
La característica de las proteínas adhesivas del mejillón que se han imitado hasta ahora es que contienen una gran cantidad de un aminoácido único llamado Dopa. La dopa es un aminoácido modificado con un grupo hidroxilo más unido a la tirosina, y la investigación sobre la adhesión bajo el agua comenzó con el hecho de que la Dopa constituye un componente importante de la proteína adhesiva.
Sin embargo, el equipo de investigación cuestionó el hecho de que esta excelente adhesión bajo el agua de los mejillones sea posible gracias a una sola molécula y se centró en observar el número y la ubicación de la lisina. que es un aminoácido que ocurre con tanta frecuencia como Dopa.
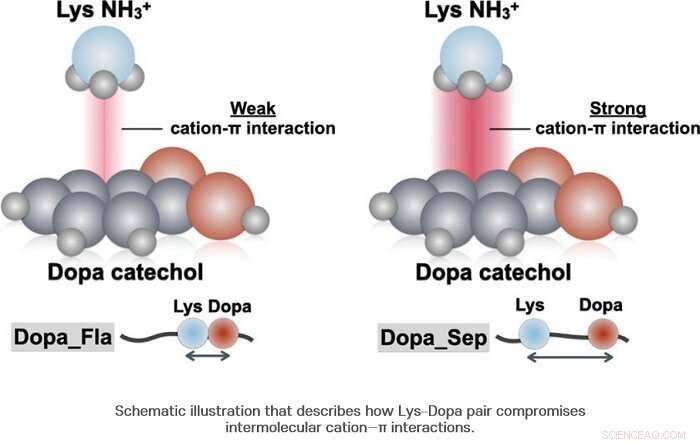
Como resultado, el equipo de investigación descubrió que la dopa y la lisina se unen entre sí con aproximadamente la mitad de la probabilidad. Por otra parte, se reveló que a diferencia de lo que se ha conocido hasta ahora, cuando la dopa y la lisina se unen, no siempre producen una sinergia positiva. Los investigadores confirmaron que en el caso de la interacción catión-π, más bien se produce una sinergia negativa.
Cuando la dopa y la lisina están juntas, se produce una diferencia en la densidad de las moléculas de agua a nivel microscópico y se reduce la concentración de moléculas de agua alrededor de la Dopa. Esta concentración reducida permite una diferencia en la fuerza de enlace de hidrógeno entre el anillo de benceno y el grupo hidroxilo de Dopa, reduciendo así la estabilidad estructural del complejo catión-π. Usando espectroscopía Raman, el equipo de investigación confirmó que el CH 2 grupo ubicado en la cadena de lisina situado cerca de Dopa y catecol de la Dopa adyacente forman una interacción intramolecular, reduciendo así su estabilidad.
Los hallazgos de este estudio permiten confirmar cómo se diseñó la proteína adhesiva de los mejillones, y parece prometedor para ser aplicable a la investigación de proteínas adhesivas de otros organismos en el futuro.
"Con este nuevo descubrimiento sobre la sinergia entre Dopa y lisina, que se sabe que siempre juegan un papel positivo en la adhesión bajo el agua, cambiará el marco de la forma en que se diseñan los materiales adhesivos, "comentó el profesor Hyung Joon Cha, quien dirigió la investigación.
Esta investigación, que fue publicado recientemente en Química de Materiales , se realizó como parte del estudio titulado "Comprensión del mecanismo de adhesión submarina de los organismos adhesivos:control del equilibrio entre la adhesión y la cohesión de la superficie, "que es un programa de investigación a mitad de carrera del Ministerio de Ciencia y TIC y la Fundación Nacional de Investigación de Corea.