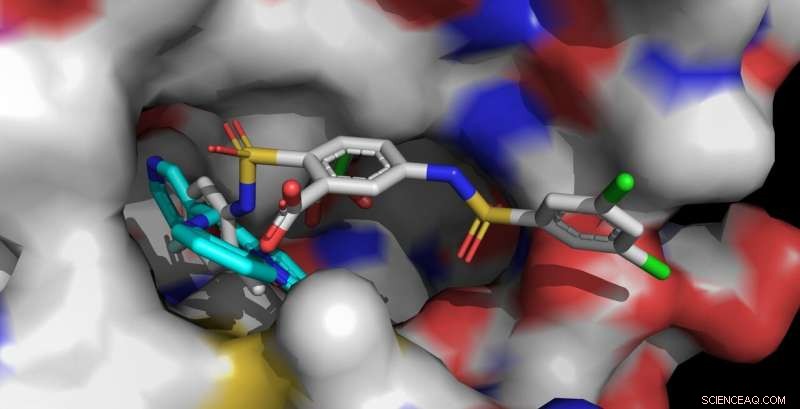
Los activadores Sirt6 UBCS039 (cian, delantero izquierdo) y MDL-801 (multicolor, delantero derecho) están anclados en el mismo bolsillo de encuadernación de Sirt6. La molécula MDL-801 más larga también contacta con áreas de superficie adyacentes e interactúa más fuertemente con Sirt6. Crédito:Clemens Steegborn
En la búsqueda de formas de combatir eficazmente las enfermedades humanas relacionadas con la edad, la enzima sirtuina 6 (Sirt6) se ha convertido recientemente en un foco de investigación bioquímica. Una activación dirigida de Sirt6 podría prevenir o mitigar tales enfermedades, por ejemplo, algunos tipos de cáncer. En un artículo para la revista Biología química de la naturaleza , Los bioquímicos de la Universidad de Bayreuth han demostrado ahora cómo la pequeña molécula MDL-801 se une a la enzima Sirt6 e influye en su actividad. Estos hallazgos pueden ayudar al desarrollo de nuevos fármacos.
El cuerpo humano contiene siete sirtuinas diferentes, llamado Sirt1 a Sirt7. Estas enzimas juegan un papel esencial en la regulación del metabolismo y las reacciones de estrés. En años recientes, el equipo de investigación dirigido por el Prof. Dr. Clemens Steegborn de la Universidad de Bayreuth ha demostrado en varios artículos de investigación cómo Sirt6 puede ser activado por moléculas pequeñas. Con su estudio, ahora publicado en Biología química de la naturaleza , Steegborn y su asistente de investigación, el Dr. Weijie. Han dado seguimiento a estos hallazgos. Descubrieron que la molécula MDL-801 interactúa con Sirt6 mediante el uso de una característica estructural única de esta enzima:un bolsillo de unión inusualmente ancho que es fácilmente accesible desde el exterior y que normalmente participa en la interacción con las proteínas del sustrato. Esta cavidad molecular continúa en un canal abierto que conduce al centro catalítico de Sirt6. Es en este canal, característica de Sirt6, que MDL-801 ancla cuando activa la enzima. Principalmente a través de estudios de actividad y análisis de estructuras de rayos X, Steegborn y You pudieron identificar tanto el sitio de unión como los procesos moleculares involucrados en la activación de Sirt6 por MDL-801.
Como ya han demostrado los bioquímicos de Bayreuth en estudios anteriores, las sustancias activas UBCS039, quercetina, y fluvastatina también pueden activar Sirt6. Para hacerlo utilizan el mismo canal abierto en el que se acopla el MDL-801. Esta cavidad alargada también se llama canal de acilo. Tan pronto como Sirt6 esté en un estado activado, separa los grupos acilo de las proteínas. De este modo, influye, entre otras cosas, la síntesis de proteínas controladas por genes. Los hallazgos sobre la activación de Sirt6, por lo tanto, ofrecen pistas valiosas para el desarrollo de sustancias activas que podrían contrarrestar las enfermedades relacionadas con el envejecimiento, por ejemplo, el desarrollo de tumores.
"Todas las moléculas pequeñas para las que hasta ahora hemos podido demostrar un efecto de activación sobre Sirt6 utilizan el canal de acilo para unirse a Sirtuin 6. Y aunque sus estructuras químicas son muy diferentes, hacen esto de formas muy similares. Esto nos abre la oportunidad de utilizar los detalles de sus respectivas interacciones para ajustar los compuestos activadores. Entonces, tales medicamentos podrían regular Sirt6 de una manera específica. De este modo, podrían usarse de manera específica para prevenir o curar enfermedades asociadas con el proceso de envejecimiento, "dice Steegborn.
Con su nuevo estudio, Steegborn y You han refutado una afirmación clave que un grupo de investigación de Shanghai publicó en Biología química de la naturaleza en 2018. En este documento, MDL-801 se describió como un nuevo activador de Sirt6. Se utilizó una estructura cristalográfica de rayos X para mostrar que MDL-801 se une a una sección molecular diferente de Sirt6 que otros activadores. "Esta estructura, que resultó de una mala interpretación de los datos experimentales, ha engañado a numerosos equipos de investigación desde su publicación. Nuestro estudio corrige este error y, por lo tanto, permite trabajar de manera eficiente en activadores mejorados, "dice Steegborn.