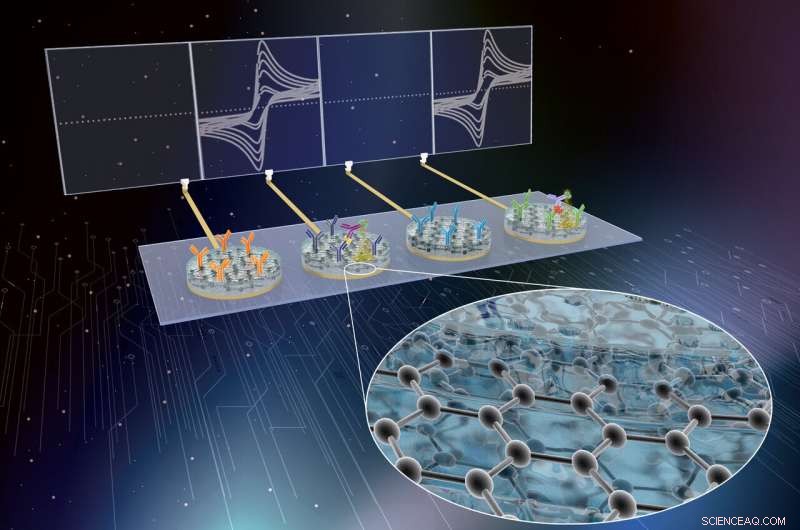
Los investigadores del Wyss Institute han desarrollado la tecnología eRapid como un Plataforma de sensores de diagnóstico electroquímico de bajo costo para la detección multiplexada de biomarcadores de sepsis clínicamente relevantes en sangre total. Crédito:Instituto Wyss de la Universidad de Harvard
Muchas afecciones médicas potencialmente mortales, como la sepsis, que se desencadena por patógenos transmitidos por la sangre, no se puede detectar con precisión y rapidez suficiente para iniciar el tratamiento correcto. En pacientes que han sido infectados por un patógeno desconocido y progresan a sepsis manifiesta, cada hora adicional en la que no se puede administrar un antibiótico eficaz aumenta significativamente la tasa de mortalidad, por eso el tiempo es de suma importancia.
El desafío de diagnosticar rápidamente la sepsis proviene del hecho de que la medición de un solo biomarcador a menudo no permite un diagnóstico claro. Los ingenieros han luchado durante décadas para cuantificar simultáneamente múltiples biomarcadores en sangre completa con alta especificidad y sensibilidad para aplicaciones de diagnóstico en el punto de atención (POC), ya que esto evitaría pasos de procesamiento de sangre costosos y que consumen mucho tiempo y en los que las moléculas de biomarcadores informativos podrían perderse. .
Ahora, un equipo multidisciplinario del Instituto Wyss de Ingeniería de Inspiración Biológica de Harvard y la Universidad de Bath, REINO UNIDO, dirigido por el director fundador de Wyss, Donald Ingber, MARYLAND., Doctor., y el científico principal de Wyss, Pawan Jolly, Doctor., ha desarrollado aún más la tecnología eRapid del Instituto como un Plataforma de sensores de diagnóstico electroquímico de bajo costo para la detección multiplexada de biomarcadores clínicamente relevantes en sangre total. El dispositivo utiliza un nuevo recubrimiento de superficie basado en nanocompuestos de grafeno y se demostró que detecta con precisión tres biomarcadores de sepsis diferentes simultáneamente. Los hallazgos se informan en Materiales funcionales avanzados .
"En este estudio, Hemos dado un paso importante hacia la implementación de nuestra plataforma de sensores electroquímicos en entornos clínicos para la detección rápida y sensible de múltiples analitos en sangre completa humana. Como el revestimiento de nanocompuestos que desarrollamos aquí es económico, tiene el potencial de revolucionar los diagnósticos en el punto de atención no solo para probar los biomarcadores de sepsis, pero una gama mucho más amplia de biomarcadores que se pueden multiplexar en conjuntos para informar sobre el estado de muchas enfermedades y afecciones, "dijo Ingber, quien también es líder de la plataforma de Diagnóstico y Terapéutica Bioinspirada del Instituto Wyss, y el profesor Judah Folkman de Biología Vascular en la Escuela de Medicina de Harvard y el Hospital de Niños de Boston, y Catedrático de Bioingeniería en SEAS.
Ingber, Jolly y su equipo de Wyss también están desarrollando actualmente sensores electroquímicos eRapid con el recubrimiento nanocompuesto a base de grafeno recientemente diseñado como un componente crítico de un diagnóstico en el punto de atención para COVID. lesión cerebral traumática, infarto de miocardio, y muchos otros trastornos.
Al desarrollar su tecnología electroquímica de detección de sepsis, El equipo de Ingber se basó en trabajos anteriores publicados en Nanotecnología de la naturaleza , en el que habían resuelto el problema de la "bioincrustación" con elementos sensores electroquímicos con su tecnología eRapid. En teoria, Los biosensores electroquímicos serían los preferidos para muchas aplicaciones clínicas debido a su capacidad para cuantificar el contenido de muestras biológicas convirtiendo directamente el evento de unión de un biomarcador en una señal electrónica. su bajo consumo y coste de energía, y fácil integración con lectores de diagnóstico. Sin embargo, especialmente cuando se usa sangre entera, Muchos componentes sanguíneos se unen de forma inespecífica a los revestimientos superficiales de los electrodos de los sensores y provocan su degradación. así como ruido eléctrico en forma de señales falsas.
La tecnología eRapid del equipo utiliza un nuevo recubrimiento nanocompuesto antiincrustante para electrodos a los que se adhieren reactivos de unión que capturan moléculas de biomarcadores de pequeñas cantidades de sangre y otros fluidos biológicos complejos. Al detectar químicamente cualquiera de estas moléculas de biomarcadores con alta sensibilidad y selectividad, la plataforma eRapid genera una señal eléctrica en los electrodos que se correlaciona en fuerza con los niveles de moléculas objetivo que se detectan. El revestimiento de nanocompuestos inicial permitió una excelente conversión de señales químicas a eléctricas, y se basó en diminutos nanocables de oro conductores de electricidad que estaban incrustados en una matriz de una proteína entrecruzada conocida como albúmina de suero bovino. Sin embargo, los altos costos de los materiales de oro habían sido la principal barrera para comercializar eRapid para aplicaciones clínicas.
"En nuestra versión avanzada de eRapid, Reemplazamos los nanocables de oro del revestimiento con nanoflakes de óxido de grafeno que también tienen propiedades antiincrustantes y electroquímicas. pero son mucho menos costosos y permiten mediciones aún más sensibles. De hecho, los costos de fabricación del nanocompuesto se redujeron a una fracción de su costo original, que junto con la velocidad de la tecnología de detección, eficiencia, y la versatilidad deberían permitir que la plataforma eRapid tenga un impacto comercial inmediato, "dijo Jolly.
Después de optimizar y caracterizar su recubrimiento de nanocompuestos en ensayos de unión para la citocina inflamatoria interleucina 6, el equipo lo aplicó al diagnóstico de sepsis. Esencialmente, uniendo una molécula de anticuerpo al recubrimiento que se une a la procalcitonina (PCT), y agregar un segundo anticuerpo específico de PCT al complejo que está ligado a una enzima, se forma un precipitado a partir de un sustrato químico y se deposita sobre el revestimiento. Esto cambia la corriente de electrones que llegan al electrodo, y ayuda a registrar el evento vinculante del PCT como una señal electrónica.
"Demostramos que este elemento sensor electroquímico puede detectar PCT con alta precisión en sangre total, y lo validó cuantificando los niveles de PCT en 21 muestras clínicas, comparándolo directamente con un ensayo ELISA convencional, con una excelente correlación, "dijo el primer autor Uroš Zupančič, quien fue un académico visitante en el grupo de Ingber de la Universidad de Bath. Zupančič es un Ph.D. candidato guiado por los coautores del estudio Despina Moschou, Doctor., profesor de la Universidad de Bath, y Pedro Estrela, Doctor., Profesor asociado y director del Centro de Biosensores, Bioelectrónica y Biodispositivos en la Universidad.
Luego, el equipo extendió su enfoque para detectar simultáneamente múltiples biomarcadores de sepsis diseñando también elementos sensores para la proteína C reactiva. otro biomarcador de sepsis, y patrones moleculares asociados a patógenos (PAMP). El elemento sensor PAMP en particular aprovecha la tecnología de captura de patógenos de amplio espectro del Instituto Wyss que utiliza una proteína diseñada genéticamente llamada FcMBL. que se une a más de 100 patógenos diferentes de todas las clases, así como moléculas en sus superficies que se liberan a la sangre cuando los patógenos mueren (PAMP) y actúan para desencadenar la cascada de sepsis.
"El ensamblaje de tres elementos sensores electroquímicos dedicados para biomarcadores que pueden estar presentes en la sangre en concentraciones muy diferentes en un solo chip representó un desafío significativo. Sin embargo, los tres elementos en el sensor final exhibieron respuestas específicas dentro del rango clínicamente significativo sin interferir entre sí, y lo hicieron con un tiempo de respuesta de 51 minutos, que satisfaga la necesidad clínica de diagnóstico de sepsis dentro de la primera hora, "dijo Zumpančič.
Para hacer que la tecnología eRapid actual sea aún más eficaz y útil para el análisis de muestras clínicas, el equipo lo integró con un sistema de microfluidos que extrae el elemento humano involucrado en el manejo del sensor en el laboratorio, y mejora el número de eventos de unión de biomarcadores en su superficie. Esto permite automatizar el análisis de biomarcadores con el sistema, y permitió a los investigadores reducir el tiempo de respuesta para medir la PCT a 7 minutos.