
Cristales de AR3 observados bajo luz polarizada (izquierda). Crédito:Los derechos de autor de las imágenes pertenecen a los autores según los términos y condiciones de Nature Communications.
Por primera vez, un equipo internacional de investigadores ha visualizado la proteína sensible a la luz archaerhodopsin-3 (AR3) con una resolución sin precedentes utilizando las líneas de luz I24 y B23 en Diamond Light Source. El fotorreceptor es expresado por Halorubrum sodomense, un organismo que crece en el Mar Muerto, pero es mejor conocido por sus aplicaciones en experimentos de optogenética, en el que se utiliza para silenciar neuronas individuales y detectar cambios en el voltaje de la membrana celular. Estas nuevas estructuras abren el camino para el desarrollo de nuevas herramientas y metodologías en los campos de la neurociencia, biología celular y más.
En su papel publicado hoy en Comunicaciones de la naturaleza , el equipo informa sobre la primera estructura del estado fundamental de AR3. En este estado, la proteína está configurada para transportar una H + ion a través de la membrana celular por cada fotón absorbido. El equipo también pudo cristalizar el fotorreceptor en una segunda conformación, un estado desensibilizado que es adoptado por AR3 en ausencia prolongada de luz.
El autor correspondiente, el Prof. Anthony Watts de la Universidad de Oxford, dice; "La excelente resolución que hemos logrado para estas estructuras AR3, 1,07 Å para el estado fundamental, se encuentra entre los más altos para una proteína de membrana de tipo salvaje depositada hasta la fecha en el Protein Data Bank. Esta cualidad nos permite visualizar directamente la compleja distribución de las moléculas de agua dentro del receptor y describir el significado funcional de las intrincadas redes de enlaces de hidrógeno que forman. algo que es importante en muchas biomoléculas, no solo en los fotorreceptores. Estas redes en AR3 implican interacciones con el grupo retiniano y las cadenas laterales de aminoácidos y, en este papel, hemos mostrado cómo se alteran entre el suelo y los estados desensibilizados de la proteína ".
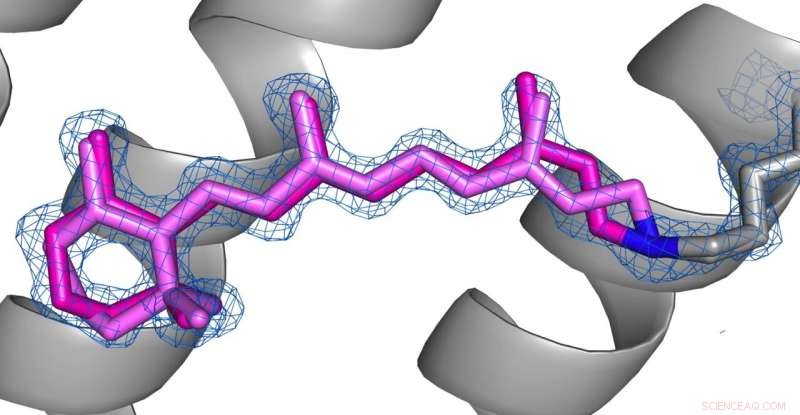
Comparación de las conformaciones de la retina (rosa) en el estado desensibilizado (imagen 1) y el estado fundamental (imagen 2) de AR3. Crédito:Los derechos de autor de las imágenes pertenecen a los autores según los términos y condiciones de Nature Communications.
Explicando el significado de la proteína AR3, comentarios del primer autor conjunto, el Dr. Juan Francisco Bada Juárez; "Los emocionantes desarrollos en optogenética durante la última década han llevado a un gran interés en el AR3 por parte de científicos de todo el mundo. Los mutantes de la proteína se utilizan de forma rutinaria en experimentos de neurociencia para silenciar selectivamente las células nerviosas individuales y también para detectar cambios en el voltaje transmembrana. Sin embargo, , estos mutantes se han diseñado sin conocimiento de la estructura de la proteína en sí. Nuestros datos proporcionan a los biólogos estructurales e ingenieros de proteínas los 'planos' para AR3 y, como resultado, podemos esperar una aceleración significativa en el desarrollo de nuevas herramientas optogenéticas ".
La coautora correspondiente Dra. Isabel Moraes del Laboratorio Nacional de Física (NPL) agrega:
"Los datos de difracción de muy alta resolución nos han permitido observar con gran detalle la libertad de movimiento de varios aminoácidos clave y moléculas de agua individuales dentro del fotorreceptor. Resolver las estructuras AR3 fue extremadamente desafiante, debido a la complejidad de las características que podemos distinguir a resolución atómica. Muchas cadenas laterales de aminoácidos dentro de la proteína se resolvieron en más de una posición u orientación, indicando su importancia para la función de las proteínas. El conocimiento de la dinámica de estos grupos fue clave para comprender cómo se llevan a cabo los procesos de sensibilización y desensibilización ".
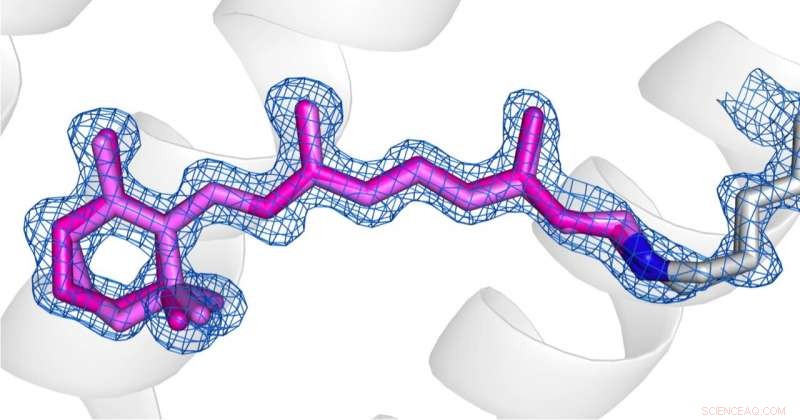
Comparación de las conformaciones de la retina (rosa) en el estado desensibilizado (imagen 1) y el estado fundamental (imagen 2) de AR3. Crédito:Los derechos de autor de las imágenes pertenecen a los autores según los términos y condiciones de Nature Communications.
Esencial para comprender el funcionamiento de la proteína, fueron las estructuras cristalinas de alta resolución resueltas por el equipo. La obtención de datos de difracción de tan alta calidad no habría sido posible sin la línea de luz de microfoco de última generación en Diamond Light Source, el sincrotrón nacional del Reino Unido, cerca de Didcot en Oxfordshire. El equipo trabajó en estrecha colaboración con varios expertos de Diamond.
"Los microcristales cultivados por los equipos de Oxford y NPL se adaptaron perfectamente a las capacidades de la línea de luz I24. Usando software desarrollado por el grupo de desarrollo de software DIALS en Diamond, pudimos combinar imágenes de difracción de múltiples cristales para obtener conjuntos de datos completos. La combinación de la entrega precisa de rayos X de microfoco y el análisis avanzado de datos nos permitió llevar la resolución de las estructuras resultantes al límite ", dice el Dr. Danny Axford, científico senior de Diamond Beamline.
En conclusión, el profesor Watts agrega:"Este ha sido un estudio fascinante. Ha sido un placer trabajar con tantos colegas expertos tanto en el Reino Unido como en todo el mundo. No solo ahora tenemos un conocimiento muy detallado de las estructuras de dos estados funcionales importantes de AR3, pero los conocimientos adquiridos profundizan nuestra comprensión de cómo se producen los procesos de sensibilización y desensibilización en muchas otras proteínas receptoras ".