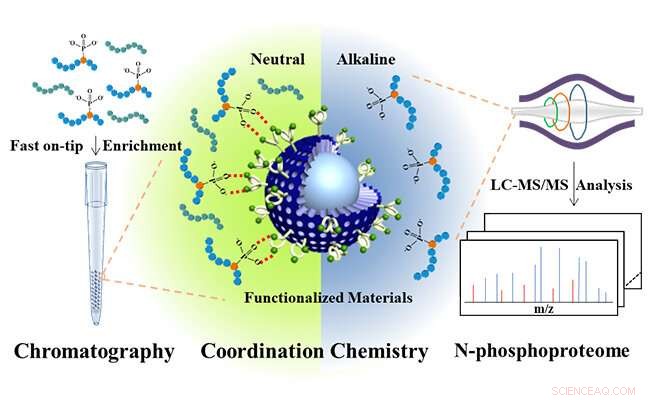
Microesferas core-shell sub-2 μm funcionalizadas con bis (zinc (II) -dipicolilamina) para el análisis de N-fosfoproteoma. Crédito:JIANG Bo y HU Yechen
La N-fosforilación de proteínas juega un papel crítico en el metabolismo central y en la señalización de dos componentes / múltiples de los procariotas. Es más, existe como intermediarios de algunas enzimas importantes en los mamíferos.
Sin embargo, los métodos de enriquecimiento actuales para O-fosfopéptidos no se prefieren para N-fosfopéptidos debido a la labilidad intrínseca del enlace P-N en condiciones ácidas. Por lo tanto, el análisis eficaz del N-fosfoproteoma sigue siendo un desafío.
Recientemente, un grupo de investigación dirigido por el Prof. Zhang Lihua y Pro. Zhang Yukui del Instituto de Física Química de Dalian (DICP) de la Academia de Ciencias de China (CAS) propuso una estrategia de enriquecimiento de N-fosfopéptidos rápida y eficaz.
Su estudio fue publicado en Comunicaciones de la naturaleza el 4 de diciembre.
Inspirado en fosfatasas naturales, que proporcionan bolsas enzimáticas centrales específicas de Zn (II) para unir unidades de fosfato de sustratos, Los investigadores diseñaron bis (zinc (II) -dipicolilamina) molecular (DpaZn) para el reconocimiento de objetivos de fosfato en condiciones neutrales.
Combinando la capacidad de transferencia de masa rápida de las microesferas de sílice núcleo-capa de menos de 2 μm, Microesferas de sílice core-shell funcionalizadas con DpaZn sub-2 μm (SiO 2 @DpaZn) fueron diseñados para el enriquecimiento de N-fosfopéptidos en la punta en condiciones neutrales. En total, 3, 384 sitios N-pho, que contiene 611 pHis, 1618 pLys y 1155 pArg, se identificaron a partir de lisados de células HeLa.
El nuevo método de análisis del proteoma N-fosforilado proporciona no solo datos básicos para un estudio en profundidad de su función biológica, sino también soporte técnico para promover el desarrollo de la medicina de precisión, biología sintética y otros campos.