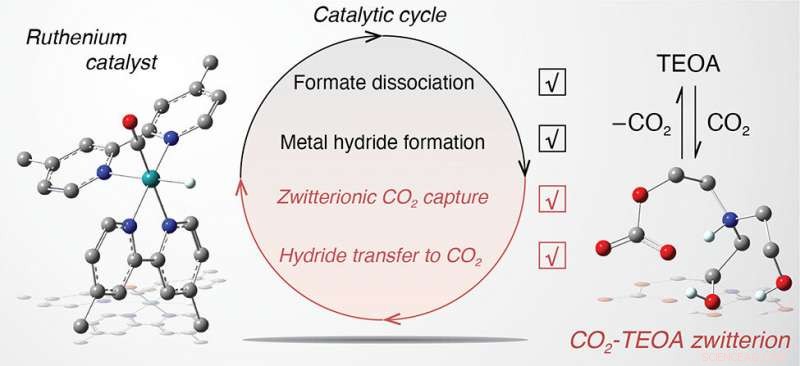
La trietanolamina (TEOA) participa activamente en los pasos de reacción clave del ciclo fotocatalítico para la conversión de dióxido de carbono (CO2) por complejos de rutenio carbonilo. Crédito: Revista de la Sociedad Química Estadounidense
Las plantas toman energía de la luz solar para transformar el dióxido de carbono (CO2) atmosférico en azúcares y luego en otros materiales para el crecimiento y las funciones metabólicas. Imitar esta reacción fotoquímica para convertir de manera eficiente el CO2 en combustibles y productos químicos de importancia industrial respaldaría un futuro energético sostenible y reduciría las emisiones de gases de efecto invernadero.
Para realizar tal fotosíntesis artificial, Los científicos han estado estudiando sistemas catalíticos compuestos por múltiples componentes que trabajan juntos para impulsar la transferencia de electrones fotoinducidos necesarios para convertir el CO2 en productos ricos en energía. Uno de esos productos es el formato, una forma de sal del ácido fórmico, una sustancia química orgánica natural hecha de moléculas de hidrógeno y CO2. La producción de formiato a partir de CO2 se considera una estrategia atractiva para el almacenamiento a largo plazo de energía solar renovable en forma química.
Los sistemas de conversión de CO2 multicomponente suelen incluir un fotosensibilizador, un catalizador, y un donante de electrones de sacrificio en solución. Al absorber la luz, el fotosensibilizador salta a un estado excitado, donde acepta electrones del donante. El catalizador, cuya función es minimizar la barrera de alta energía para activar el CO2, una molécula muy estable, luego usa estos electrones de alta energía para completar una serie de reacciones.
Para muchos estudios sobre la conversión fotoquímica de CO2 utilizando catalizadores moleculares, como los basados en rutenio y otros complejos metálicos, trietanolamina (TEOA) es el componente que dona los electrones. O, en algunos casos, TEOA está aceptando un protón (ion hidrógeno cargado positivamente) de un donante de electrones más eficiente para asegurar su comportamiento de sacrificio. A pesar del amplio uso de TEOA, gran parte de la investigación hasta la fecha no ha considerado la posibilidad de que este componente desempeñe funciones secundarias, como cambiar las especies químicas temporales (intermedios) generadas dentro del ciclo catalítico o aumentar las velocidades de reacción.
Un equipo de químicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) y el Baruch College de la Universidad de la Ciudad de Nueva York se propusieron cambiar eso.
"Durante los últimos 40 años, La mayoría de los estudios sobre catalizadores de reducción de CO2 se han centrado en analizar la eficiencia catalítica y la selectividad para el producto final. "dijo Renato Sampaio, investigador asociado en el Grupo de Fotosíntesis Artificial de la División de Química del Laboratorio Brookhaven. "Sin embargo, es importante saber si la TEOA interactúa con el catalizador y cómo interactúa durante los pasos intermedios del ciclo catalítico, porque estas interacciones pueden influir decisivamente en la eficiencia y selectividad de la formación del producto ".
Centrándose en un sistema catalítico bien conocido en una solución de acetonitrilo que consiste en un catalizador de rutenio carbonilo (átomo de carbono unido al átomo de oxígeno), un fotosensibilizador a base de rutenio, un donante de electrones común conocido como BIH, y TEOA que actúa como aceptor de protones para promover el comportamiento de sacrificio de BIH, los químicos hicieron algunos descubrimientos sorprendentes. Como informaron en un artículo publicado en línea el 27 de diciembre en el Revista de la Sociedad Química Estadounidense , TEOA falla en su tarea principal prevista de aceptar protones de BIH de manera eficiente, limitando así la actividad catalítica. Sin embargo, TEOA mejora los pasos clave del ciclo catalítico para la conversión de CO2 en formiato, el producto de destino.

En la División de Química de Brookhaven Lab, (desde la derecha) David Grills, Renato Sampaio, y Etsuko Fujita discuten los resultados de una investigación espectroelectroquímica de uno de una serie de catalizadores de carbonilo de rutenio mientras Dmitry Polyansky instala una celda electroquímica para el próximo experimento. El equipo, también incluye a David Szalda de Baruch College (no en la foto), descubrió que un componente ampliamente utilizado en la reducción fotoquímica (inducida por la luz) de dióxido de carbono en productos ricos en energía utilizables mejora los pasos clave del ciclo catalítico. Crédito:Laboratorio Nacional Brookhaven
Por ejemplo, TEOA actúa como una fuente de protones que apoya la formación de un hidruro metálico (rutenio unido al hidrógeno) que posteriormente interactúa con el CO2 para producir formiato unido (unido al rutenio). Es más, TEOA interactúa con el CO2 para formar un "aducto zwiteriónico, "una molécula que contiene cargas eléctricas tanto positivas como negativas. Cuando este aducto está presente en solución, el hidruro metálico interactúa con el CO2 para producir formiato unido a una velocidad seis órdenes de magnitud más rápida que sin TEOA. La disociación del formato unido en formato "libre", que puede capturarse como producto final, también es seis órdenes de magnitud más rápida debido a la TEOA.
Para hacer estas determinaciones, el equipo recopiló datos tanto electroquímicos como espectroscópicos.
"El ciclo catalítico puede generar una gran cantidad de intermedios de reacción, "explicó el coautor correspondiente, Etsuko Fujita, líder del Grupo de Fotosíntesis Artificial. "El desafío es caracterizarlos mediante técnicas espectroscópicas o electroquímicas".
Primero, el equipo midió los potenciales de reducción del catalizador (la facilidad con la que el catalizador gana un electrón) en presencia y ausencia de TEOA. Luego, caracterizaron las vibraciones espectroscópicas del carbonilo para diferentes formas del catalizador antes y después de recibir un electrón. Siguiendo estas mediciones electroquímicas, llevaron a cabo experimentos de espectroscopía infrarroja de resolución temporal en escalas de tiempo de nanosegundos para monitorear los intermedios catalíticos en una atmósfera de CO2.
"El carbonilo que está unido al rutenio nos permitió estudiar cada forma intermedia transitoria del catalizador, "explicó Sampaio." El carbonilo es un reportero espectroscópico infrarrojo muy sensible que permanece unido al rutenio durante todo el ciclo catalítico, a diferencia de otras partes del catalizador. Su frecuencia vibratoria, o movimiento atómico, cambia drásticamente cuando el catalizador acepta un electrón o sufre otros cambios estructurales. Podemos detectar estos cambios y verlos junto con las mediciones electroquímicas para saber qué especies están presentes ".
En estudios futuros, el equipo explorará alternativas a la TEOA que maximicen la capacidad de sacrificio de BIH al tiempo que ofrecen ventajas similares para mejorar el ciclo catalítico.
"Aunque nuestro estudio se centró en una clase específica de catalizadores, Creemos firmemente que nuestros hallazgos son ampliamente aplicables a otros sistemas y deben tenerse en cuenta al investigar la reducción catalítica de CO2 a formato. "dijo Fujita.