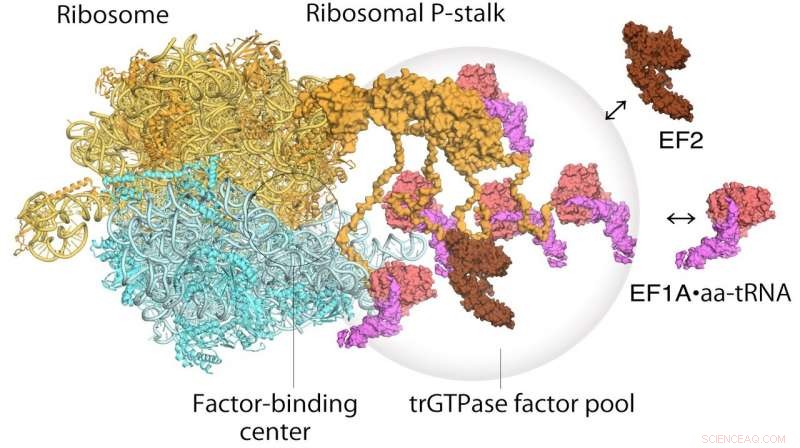
Modelo de traducción de ribosomas y factores de alargamiento. EF1A • GTP • aatRNA y EF2 se ensamblan en el tallo ribosómico en el ribosoma traductor. El conjunto de factores de traducción contribuye a la síntesis de proteínas eficiente en un entorno intracelular abarrotado. Crédito: procedimientos de la Academia Nacional de Ciencias
Los ribosomas son los complejos de ribonucleoproteínas en el corazón de la síntesis de proteínas en las células. Sin embargo, en ausencia de evidencia concluyente, cómo operan estos complejos ha sido objeto de debate. Ahora, Hirotatsu Imai y Noriyuki Kodera en la Universidad de Kanazawa, junto a Toshio Uchiumi en la Universidad de Niigata en Japón, muestran visualizaciones de la dinámica estructural y la combinación de factores que tienen lugar en las proteínas del tallo de los ribosomas a medida que construyen nuevas proteínas.
Los ribosomas se descubrieron por primera vez en la década de 1950, y su amplia función se ha entendido ampliamente durante algún tiempo:leen secuencias de ARN mensajero, y de eso, generar secuencias de aminoácidos ordenados correctamente en nuevas proteínas. La proteína del tallo del ribosoma, en particular, juega un papel integral en el proceso de síntesis de proteínas al reclutar factores proteicos responsables de la traducción y elongación de la secuencia de aminoácidos. Sin embargo, Ha sido difícil establecer la estructura de la proteína del tallo del ribosoma unida debido a su flexibilidad. Aquí, la alta resolución y la rápida captura de imágenes de la microscopía de fuerza atómica de alta velocidad resultó invaluable.
La microscopía de fuerza atómica utiliza una punta a nanoescala para rastrear las muestras, muy parecido a la aguja de un tocadiscos de vinilo que escanea un disco, excepto que los detalles identificados por un microscopio de fuerza atómica pueden tener una resolución a escala atómica. La versatilidad de la técnica para diferentes superficies ya era una gran ventaja para los estudios biológicos, pero con el advenimiento de la microscopía de fuerza atómica de alta velocidad, la técnica fue capaz de capturar procesos dinámicos por primera vez, así como. Imai, Uchiumi y Kodera utilizaron la técnica para revelar que la proteína del tallo en realidad cambia entre dos conformaciones:una que coincide con modelos estructurales anteriores y una nueva conformación completamente inesperada.
En cuanto a cómo funciona el ribosoma, Se había propuesto previamente un mecanismo de dos pasos para describir cómo se traduce la información genética a través de proteínas conocidas como factores de traducción GTPasa. El primer paso es el reclutamiento de los factores al sitio de anclaje del factor en el tallo de la proteína, aumentando así la concentración de factores allí, la denominada combinación de factores. El segundo paso es la unión y estabilización de una GTPasa de traducción en el centro de unión del factor ribosómico para catalizar la hidrólisis de GTPasa. De su estudio de microscopía de fuerza atómica de alta velocidad, los investigadores pudieron obtener la primera evidencia visual del mecanismo de agrupación del factor GTPasa traslacional por parte del tallo ribosómico.
Aunque el estudio no pudo brindar evidencia concluyente de la acción de los factores una vez ligados, los investigadores notaron que los factores parecían retenidos en las cercanías una vez que se completaba la hidrólisis de GTPasa, sugiriendo un papel potencial de la proteína del tallo en etapas posteriores de la síntesis de proteínas. Los investigadores concluyen, "El trabajo futuro con HS-AFM proporcionará más información importante para comprender los comportamientos dinámicos de estas complejas maquinarias de traslación".