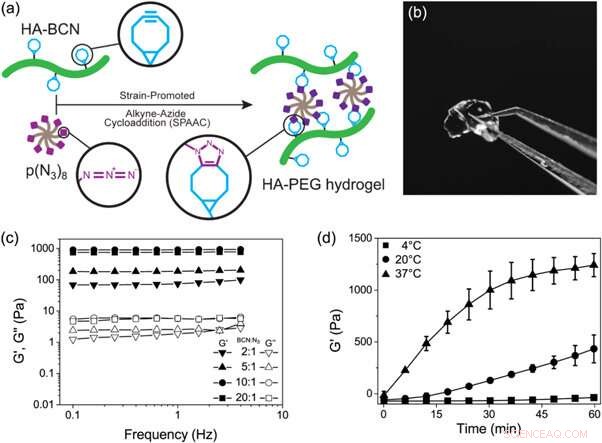
(a) Representación esquemática de la formación de hidrogeles de HA-PEG a través de una reacción de cicloadición de alquino-azida promovida por cepas. (b) Fotografía de un hidrogel HA-PEG después de la formación. (c) Barridos de frecuencia de hidrogeles de HA-PEG con diferentes proporciones de BCN a N3. (d) Experimento del tiempo de gelificación que muestra el aumento de G 'a lo largo del tiempo durante la gelificación de hidrogeles de HA-PEG (BCN:N3 10:1) a diferentes temperaturas. Crédito: Biofabricación , doi:https://doi.org/10.1088/1758-5090/aaf657
Los dispositivos de cultivo de células de hígado en un chip son modelos biomiméticos atractivos en el descubrimiento de fármacos, Investigación en toxicología e ingeniería de tejidos. Para mantener funciones específicas de las células del hígado en un chip en el laboratorio, deben cumplirse los tipos de células y las condiciones de cultivo adecuados, que incluye la orientación de las células en 3D y un suministro constante de nutrientes y oxígeno. En comparación con las técnicas convencionales de cultivo celular 2D, Los dispositivos organ-on-a-chip ofrecen versatilidad y biomimetismo eficaz adecuados para aplicaciones avanzadas en el descubrimiento de fármacos y la medicina.
En un estudio reciente ahora publicado en Biofabricación , Jonas Christoffersson y sus colegas demostraron cómo los hidrogeles que imitan la matriz extracelular pueden respaldar la funcionalidad y la viabilidad de los hepatocitos en un dispositivo de hígado en un chip perfundido. Los investigadores interdisciplinarios de la división de biotecnología y física molecular diseñaron un sistema de hidrogel basado en polímeros de hialuronano y poli (etilenglicol) (HA-PEG). Desarrollaron los hidrogeles usando química de clic. Para habilitar el proceso, los científicos llevaron a cabo una reacción biortogonal (química que ocurre dentro de los sistemas vivos sin la interferencia de reacciones bioquímicas nativas) entre un resto ciclooctina y un compañero de reacción marcado con alquina azida, conocida como cicloadición de alquino azida promovida por cepa (SPAAC).
Los nuevos materiales de hidrogel se diseñaron y caracterizaron en comparación con los hidrogeles de agarosa y alginato existentes para la compatibilidad celular (citocompatibilidad). Para estudios de biofuncionalización, Los investigadores utilizaron hepatocitos derivados de células madre pluripotentes inducidas humanas (hiPS-HEP). Para mejorar la citocompatibilidad superficial del biomaterial, Los hidrogeles de HA-PEG se alteraron con motivos de adhesión celular modificados con azida para facilitar las uniones efectivas del material celular. En la superficie biomaterial funcionalizado, las células madre de los hepatocitos migraron y crecieron en orientaciones 3D, con mayor viabilidad. Los científicos observaron una mayor producción de albúmina en el nuevo material (proteína característica del hígado), en comparación con las células cultivadas en otros hidrogeles. El flexible El sistema de hidrogel reticulado SPAAC con cultivo celular 3D perfundido de hiPS-HEP es un material prometedor para optimizar los dispositivos de hígado en un chip.
Biorreactores miniaturizados conocidos como 'órgano en chips', han surgido recientemente como modelos alternativos de cultivo celular que imitan mejor el microambiente biológico in vivo en el laboratorio. El hígado es un modelo de especial interés en la investigación médica debido a la hepatotoxicidad del fármaco observada en todas las fases del desarrollo clínico del fármaco. Las publicaciones anteriores detallan el uso de órganos en chips para predecir el resultado del impacto de un fármaco en ensayos clínicos y evaluar las interacciones del fármaco con los hepatocitos en el laboratorio.
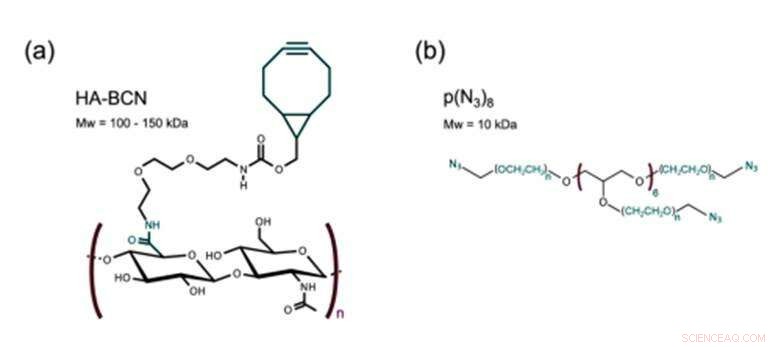
Estructura de a) HA-BCN con una relación n / m de 0,19 yb) p (N3) 8. Crédito: Biofabricación , doi:https://doi.org/10.1088/1758-5090/aaf657
Debido a su adopción más amplia en entornos académicos e industriales, los biorreactores requieren materiales y condiciones optimizados para una fabricación de alto rendimiento. Las condiciones incluyen la sustitución del material de creación de prototipos común polidimetilsiloxano (PDMS), integrando células derivadas de células madre pluripotentes inducidas (iPSC) en un biomaterial blando que facilita su crecimiento y minimiza el gran volumen muerto causado por los depósitos de microfluidos y los tubos de los dispositivos de órganos en chips.
El nuevo biomaterial preparado en el estudio contenía dos constituyentes principales reticulados a través de SPAAC; un hialuronano modificado con cicloocitno (HA-BCN) y un PEG modificado con azida de múltiples brazos [p (N 3 ) 8 ]. El BCN reaccionó con azidas (N 3 ) en el polímero PEG de 8 brazos con terminación N 3 -moieties para formar un estable 1, 2, 3-triazol. Christoffersson y col. completaron reacciones químicas en condiciones fisiológicas para formar los hidrogeles con propiedades viscoelásticas sintonizables. La estrategia de reticulación fue ideal para fabricar hidrogeles para cultivo celular en 3D; ya que las células podrían encapsularse en el biomaterial sin comprometer su viabilidad y eran adecuadas para su uso en dispositivos de microfluidos. Los científicos utilizaron restos de SPAAC en exceso en el nuevo biomaterial para unir diferentes ligandos, incluidos los péptidos RGD, para promover interacciones en la interfaz célula-material.
Después de eso, los científicos variaron la composición de los dos componentes principales para comprender las propiedades viscoelásticas resultantes, tales como el módulo de almacenamiento (G ') y el módulo de pérdida (G ") de los hidrogeles mediante reología oscilatoria (técnica para medir el comportamiento viscoelástico de materiales blandos). Controlaron la cinética de gelificación del nuevo hidrogel a temperaturas crecientes. Cinética de gelificación de El nuevo biomaterial era lo suficientemente lento para una distribución celular homogénea, pero lo suficientemente rápido como para evitar la sedimentación celular. La capacidad de controlar la cinética de gelificación permitió a los científicos considerar una variedad de estrategias de biofabricación (por ejemplo, bioimpresión) y ensamblaje de hidrogel dentro de los sistemas de microfluidos para órganos sobre aplicaciones de chips.
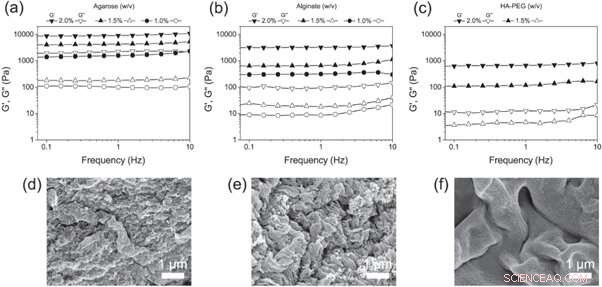
(a) - (c) Barridos de frecuencia de (a) agarosa, (b) alginato y (c) hidrogeles de HA-PEG a diferentes concentraciones. (d) - (f) Micrografías SEM de (d) agarosa, (e) alginato y (f) hidrogeles de HA-PEG que muestran la morfología de cada hidrogel. Crédito: Biofabricación , doi:https://doi.org/10.1088/1758-5090/aaf657
Christoffersson y col. A continuación se compararon los hidrogeles HA-PEG con los andamios de cultivo celular 3D bien establecidos:hidrogeles de agarosa y alginato. Para determinar las propiedades viscoelásticas finales adecuadas para experimentos de cultivo celular en 3D, utilizaron reología oscilatoria para examinar las diferentes concentraciones de polímero. Los científicos analizaron la composición de los materiales finalizados utilizando imágenes de microscopía electrónica de barrido (SEM).
El diseño y la configuración de hígado en un chip tenían que cumplir con dos criterios clave en el estudio:
1. Permitir la perfusión (paso de líquido) del medio de cultivo celular a través de la superficie del hidrogel para un intercambio constante de medios de nutrientes. ay desde los hepatocitos encapsulados.
2. Permitir la toma de muestras de los medios perfundidos para el análisis experimental durante el cultivo celular en curso, sin afectar los hepatocitos y el hidrogel.
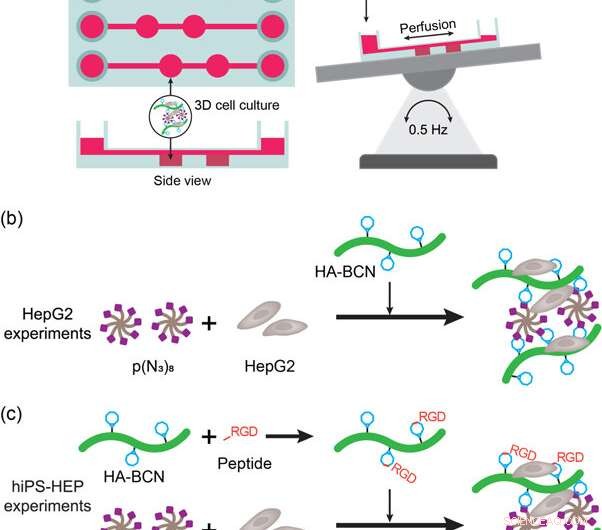
(a) Representación esquemática del dispositivo y la configuración de hígado en un chip. El dispositivo se colocó en una mesa basculante automática para permitir la perfusión de medios y nutrientes durante el cultivo celular. (b) Representación de los experimentos de cultivo celular HepG2 3D con hidrogeles HA-PEG. Las células HepG2 se añadieron a p (N3) 8 suspendido en medio antes de la adición de HA-BCN. (c) Representación de los experimentos de cultivo celular hiPS-HEP 3D con hidrogeles HA-PEG. Las células hiPS-HEP se añadieron a p (N3) 8 suspendido en medio antes de la adición de HA-BCN. En experimentos que utilizan péptido linRGD o cRGD, el HA-BCN se preincubó con 1 µM del péptido correspondiente durante 1 h antes de añadir el componente HA-BCN (RGD) a la mezcla de hiPS-HEP / p (N3) 8. Crédito: Biofabricación , doi:https://doi.org/10.1088/1758-5090/aaf657
Para cumplir con estos criterios, Los científicos utilizaron un dispositivo de cultivo celular 3D comercial (μ-Slide III 3D Perfusion IbiTreat) que contiene dos cámaras consecutivas (2 x 30 µL) en tres matrices paralelas, cada una conectada a depósitos de medios para perfundir líquido. Para una perfusión eficaz, montaron el dispositivo en una mesa oscilante automática invirtiendo la dirección de la perfusión a través de las cámaras que contienen hidrogel. La configuración experimental permitió la perfusión a través del dispositivo, cumpliendo los primeros criterios. Para cumplir con el segundo criterio, las paredes localizadas adyacentes a las cámaras de hidrogel permitieron a los científicos tomar muestras del perfundido sin interferir con el hidrogel o los componentes celulares.
Los científicos investigaron por primera vez la biofuncionalización de dispositivos de hígado en un chip en el estudio con células HEPG2 (línea celular de carcinoma de hígado) encapsuladas en hidrogeles. después de las 3, 7 y 9 días de cultivo celular. Compararon la morfología celular, viabilidad y funcionalidad con hidrogeles de agarosa y alginato. El estudio incluyó ensayos de vivo / muerto para confirmar la viabilidad celular y confirmó aún más la funcionalidad de HepG2 mediante la detección de secreciones de albúmina y urea en el sobrenadante del cultivo celular.
Para mejorar la funcionalidad de la celda (fijación a la superficie y movilidad de los materiales), los científicos injertaron motivos de adhesión celular como péptidos RGD lineales o cíclicos (linRGD lineal o cRGD cíclico) en los hidrogeles. En este caso, Se cultivaron células hiPS-HEP (células madre de hepatocitos) en diferentes composiciones de hidrogel durante 13 días para examinar la morfología y la viabilidad (tinción viva / muerta) después de las interacciones entre células y material. Los científicos utilizaron seis superficies de biomateriales diferentes a base de hidrogel en los experimentos, que incluyen; 2D (capa HEP), Agarosa Alginato HA-PEG, HA-PEG (linRGD) y HA-PEG (cRGD).
Las células hiPS-HEP encapsuladas y cultivadas en el hidrogel modificado crecieron dentro de construcciones 2D y 3D verdaderas. Para probar la funcionalidad de las células hiPS-HEP cultivadas (células madre), los científicos cuantificaron su excreción de albúmina y urea. Los resultados mostraron que solo los sobrenadantes de las células madre cultivadas en superficies 2D y en presencia de los hidrogeles del motivo cRGD secretaban albúmina.
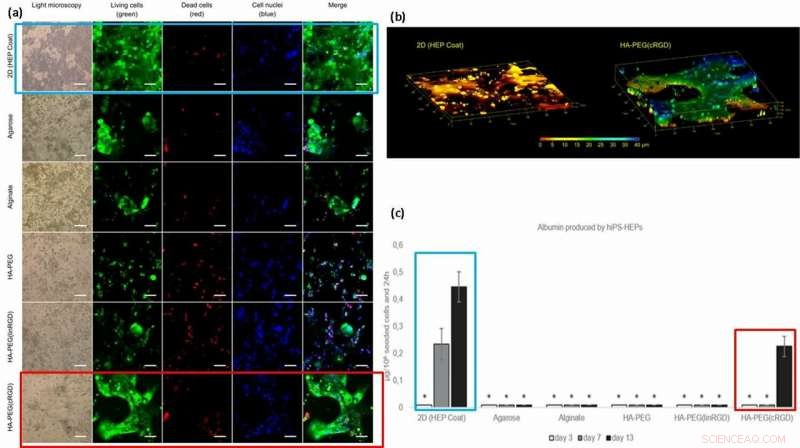
(a) Viabilidad y morfología de las células hiPS-HEP después de 13 días de cultivo. La viabilidad celular parece depender de la capacidad de la célula para adherirse a la superficie, el hidrogel, o entre ellos. Se formaron grandes estructuras de hiPS-HEP en HA-PEG (cRGD). (calceína, verde), células muertas (etidio homodímero-1, rojo), y núcleos (Hoechst 33 342, azul). (b) La pila en Z de imágenes obtenidas por microscopía confocal revela la forma plana de hiPS-HEPS cuando se cultiva en un sustrato 2D (izquierda) en comparación con las construcciones 3D de las células en un hidrogel HA-PEG (cRGD) (derecha). Los colores representan la altura por encima del fondo de la cámara del dispositivo de cultivo celular 3D, es decir, el eje Z, de 0 μm (rojo) a 40 μm (azul). (c) Albúmina producida por hiPS-HEP sobre HEP Coat en 2D y en los diferentes hidrogeles. * indica que los niveles de concentración de albúmina eran demasiado bajos para una cuantificación fiable. Crédito: Biofabricación , doi:https://doi.org/10.1088/1758-5090/aaf657
Según los resultados, los científicos atribuyeron la mayor cantidad de albúmina en la capa de HEP 2D a la velocidad de difusión de la albúmina dentro de los hidrogeles; la transferencia a través de la capa 2D es más rápida que la 3D. La mayor concentración de albúmina con hidrogeles unidos al motivo cRGD, correlacionado con el aumento del crecimiento celular y la viabilidad observados en las superficies de biomateriales unidas a cRGD. Como resultado, los científicos tienen la intención de utilizar formas cíclicas del péptido RGD para ayudar al cultivo de células madre de hepatocitos en hidrogeles preparados para dispositivos de hígado en un chip en el futuro.
De este modo, el estudio detalló las ventajas de usar hidrogel a base de hialuronano-PEG modificado con péptidos RGD para cultivos 3D de hepatocitos (aproximadamente 13 días) en una configuración de hígado en un chip. Como puntos de referencia del estudio, Christofferfsson y colaboradores utilizaron los hidrogeles de agarosa y alginato comúnmente disponibles. En el futuro, Los científicos optimizarán las propiedades viscoelásticas y la concentración de motivos de adhesión celular en el sistema de hidrogel HA-PEG para la citocompatibilidad biomimética. El sistema optimizado de hidrogel se puede combinar con la configuración del dispositivo para facilitar plataformas de hígado en un chip fisiológicamente relevantes para la investigación clínica en toxicología de medicamentos. descubrimiento de fármacos y medicina regenerativa.
© 2019 Science X Network