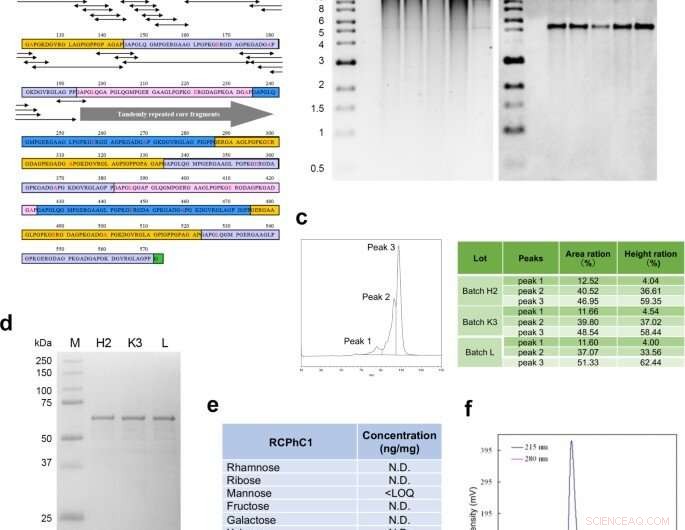
Diseño molecular y síntesis del polipéptido recombinante RCPhC1. (a) La secuencia de péptidos de RCPhC1 muestra repeticiones de Gly-Xaa-Yaa con sustituciones de aminoácidos (rojo). Todos los fragmentos de péptidos (secuencias penta mínimas) que contienen las sustituciones de aminoácidos (flechas de doble cabeza) se emparejaron con secuencias de colágeno humano. (b) Estabilidad del ADN genómico en el banco de células de trabajo. Después de cada una de las cuatro fragmentaciones consecutivas, Se aisló el ADN genómico (carriles 1 a 4) y se comparó con el ADN genómico original (carril 5). El panel derecho, Southern blot hibridó con la sonda promotora AOX1. (c) La reproducibilidad se analizó mediante cromatografía líquida. El perfil de fase inversa mostró tres picos, que se identificaron consistentemente en tres lotes diferentes (H2, K3, y yo). (d) La reproducibilidad también se evaluó mediante SDA-PAGE. La banda única de tres lotes diferentes también sugirió la ausencia de modificación postraduccional. (e) La ausencia de glicosilación postraduccional. (f) La cromatografía de permeación en gel confirmó la alta pureza de RCPhCl. Crédito:Nature Communications Materials, doi:10.1038 / s43246-020-00089-9
El estándar de oro actual para la cirugía de injerto óseo incluye autoinjertos y aloinjertos, aunque existe una demanda creciente para desarrollar biomateriales sintéticos para mejorar la biointegración en la ingeniería de tejidos óseos. En un nuevo informe ahora publicado en Materiales de comunicación de la naturaleza , Hideo Fushimi y un equipo de investigación en biociencia e ingeniería, y biotecnología reconstructiva en Japón y EE. UU., desarrolló un material de andamio biodegradable utilizando proteínas o polipéptidos recombinantes como fuente de materiales de injerto a base de hidrogel. El equipo utilizó la cadena alfa 1 de colágeno humano tipo I (abreviado RCPhC1) como fuente para desarrollar el polipéptido recombinante y demostró la flexibilidad del material para diseñar características ideales para injertos óseos. El equipo también desarrolló injertos óseos RCPhC1 utilizando un sistema altamente escalable Protocolo de producción optimizado para la generación robusta de tejido óseo maduro en el laboratorio. El injerto óseo se reabsorbió completamente después de la regeneración tisular en un modelo animal preclínico para una integración biológica eficaz.
Ingeniería de tejido óseo con biomimético, injertos de hueso sintético
En este trabajo, Fushimi y col. desarrolló un material de injerto óseo sintético utilizando una proteína recombinante abreviada RCPhC1. El desarrollo proporciona un material de origen versátil para fabricar injertos óseos sintéticos mediante ingeniería flexible. Utilizando estudios preclínicos en modelos de defectos óseos caninos y roedores, el equipo mostró una mayor eficiencia de los injertos óseos para regenerar tejido óseo con madurez estructural. En ortopedia clínica, la pérdida de volumen y función del tejido es un sello distintivo de la lesión, inflamación crónica, y enfermedades metabólicas y genéticas. Si bien el tejido óseo puede regenerarse activamente a través de la proliferación y la diferenciación osteogénica de células madre o estromales mesenquimales, Los defectos óseos grandes requieren intervenciones quirúrgicas para reparar y reconstruir los huesos con materiales de injerto óseo.
Globalmente Los cirujanos ortopédicos realizan aproximadamente 2,2 millones de procedimientos de injerto óseo anualmente en un mercado global sumamente costoso. El tejido óseo humano está compuesto de matriz extracelular orgánica, minerales de calcio y fósforo cristalizados que forman hidroxiapatita. Los materiales de injerto óseo pueden imitar la estructura y la composición bioquímica del tejido óseo. Los cirujanos ortopédicos y los investigadores han utilizado injertos óseos autólogos (células y tejido obtenidos del mismo individuo) para reparar defectos óseos debidos a problemas minerales e inmunológicos. aunque las complicaciones en los sitios de la cirugía pueden dar lugar a métodos de injerto alternativos, como aloinjertos (células y tejido obtenidos de un individuo diferente). El nuevo desarrollo de biomiméticos, Los biomateriales sintéticos para la ingeniería de tejidos óseos abordan una necesidad urgente en la industria de la salud de desarrollar nuevos materiales de injerto sin utilizar tejido humano o animal.
Factores de control de ingeniería para desarrollar estructuras isotrópicas con plantilla de hielo mediante colada por congelación de capa fina (TLFC). (a) Diagrama del aparato de fundición por congelación. (b) Medición de temperatura típica del fondo de la taza de enfriamiento (azul) y la superficie del soluto (rojo) durante el proceso de congelación. Hubo una discrepancia significativa entre la copa de enfriamiento y la superficie del soluto durante el período de congelación. (c) Diagrama de la estructura anisotrópica con plantilla de hielo y la microestructura real de RCPhC1 que contiene la zona de poros pequeños. La barra de escala equivale a 500 μm. d TLFC redujo la discrepancia de temperatura entre la taza de enfriamiento (azul) y la superficie del soluto (rojo) durante el período de congelación. (e) El efecto de la temperatura mínima y la duración del enfriamiento sobre la estructura de poro interno isotrópico. La estructura de poros uniforme (azul) se desarrolló cuando la temperatura mínima estaba por debajo de -10 ° C, pero no se vio afectada por la duración del enfriamiento. La estructura de poros internos irregulares (rojo) se desarrolló con mayor frecuencia cuando la temperatura mínima estaba por encima de -10 ° C. La barra de escala equivale a 500 μm. El área verde muestra el recuento de tortas liofilizadas uniformemente. El área roja muestra el recuento de tortas liofilizadas irregularmente. (f) El efecto de la temperatura del bloque sobre el tamaño de los poros internos. Los diamantes muestran valores medios. Las temperaturas de bloque más bajas aumentaron el número de poros pequeños. La barra de escala equivale a 500 μm. (g) La estructura interna desarrollada por la agitación (círculos rojos), Los métodos de fundición por congelación anisotrópicos (círculos verdes) e isotrópicos (círculos azules) se evaluaron mediante análisis de absorción de agua y descomposición ácida. Las esponjas de RCPhC1 se reticularon tentativamente deshidrotermal a 130 ° C durante 7 h. Las líneas azules en los paneles byd indican el registro de temperatura del termopar en la parte inferior de las soluciones. Las líneas rojas indican eso en la superficie de la solución. Crédito:Nature Communications Materials, doi:10.1038 / s43246-020-00089-9 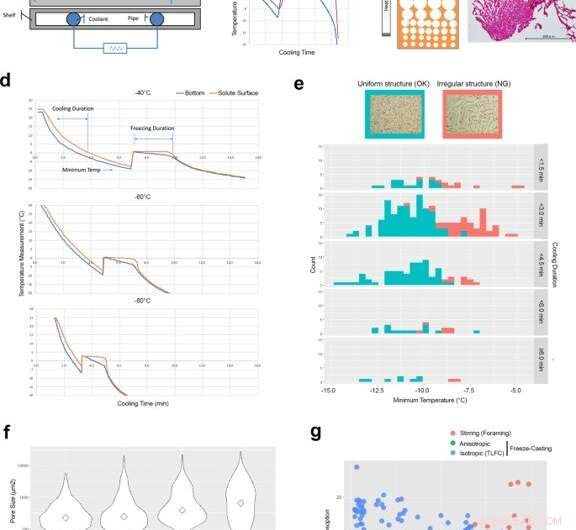
El equipo usó colágeno tipo I, abundantemente expresado en tejidos conectivos y membranas intersticiales como un componente orgánico principal del tejido óseo. La secuencia de proteínas del colágeno tipo I juega un papel importante en el establecimiento de la resistencia mecánica del hueso. El equipo primero clonó el ADN complementario (ADNc), una copia de ADN de una molécula de ARN mensajero (ARNm) que codifica el polipéptido (secuencia de proteína) RCPhC1, en un vector de expresión. Para lograr esto, utilizaron una especie de levadura metilotrófica conocida como Pichia pastoris para transferir la secuencia y generar bancos de células maestras y de trabajo. El equipo confirmó la composición de aminoácidos del polipéptido sintético y caracterizó ampliamente el producto.
Luego diseñaron la estructura interna del material del injerto para cumplir con los requisitos específicos del tejido objetivo. Para generar una estructura de poros uniforme, por lo tanto, Fushimi y col. diseñó un protocolo de congelación de capa fina (TLFC). El enfoque de congelación versátil generó una gran cantidad de poros con paredes delgadas para formar un andamio RCPhC1 isotrópico con varias estructuras internas.
Factores de ingeniería que afectan la reticulación deshidrotérmica de RCPhC1 para controlar la tasa de biodegradación y la resistencia mecánica. a) El efecto de la temperatura de reticulación y la duración de la reticulación sobre la tasa de biodegradación evaluado mediante análisis de descomposición ácida in vitro. (b) La temperatura de reticulación no influyó linealmente en la tasa de supervivencia de la descomposición ácida. Considerando la esterilización posterior, la temperatura de reticulación se fijó en 130 ° C. (c) Se encontró que la duración de la reticulación era el factor de control predominante, que aumentó linealmente la tasa de supervivencia a la descomposición ácida de RCPhC1 hasta 10 h. El material de gelatina porcina respondió de manera similar a la duración de la reticulación, aunque requiriendo una duración mucho más larga. (d) Propiedad física de RCPhC1 reticulado deshidrotermal. La propiedad física equivalente de la gelatina porcina reticulada deshidrotermal requirió una duración de reticulación 10 veces mayor. e) La resistencia mecánica del RCPhC1 reticulado deshidrotermal (130 ° C, 7 h) fue significativamente mayor que la de la gelatina porcina reticulada deshidrotermal (130 ° C, 72 h). La barra de error representa s.d. (f) RCPhC1 reticulado deshidrotermal (130 ° C, 7 h) se trató con tripsina y se sometió a CL de alto rendimiento. La co-migración de fragmentos de péptidos indicó múltiples sitios de reticulación. Crédito:Nature Communications Materials, doi:10.1038 / s43246-020-00089-9 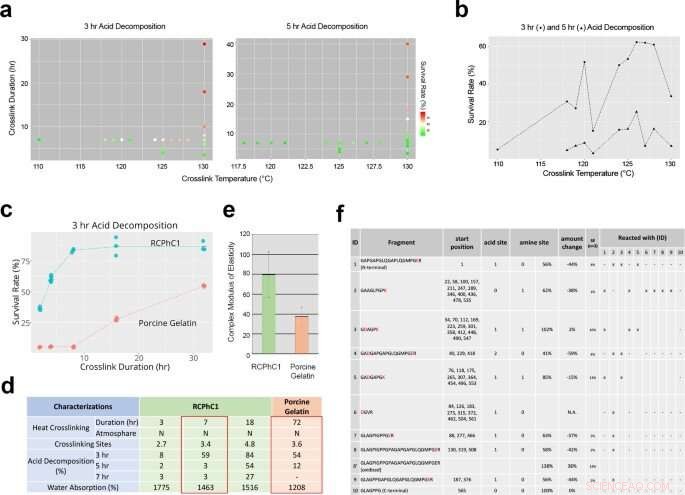
Fushimi y col. a continuación, sometió el material a un tratamiento de reticulación deshidrotermal para probar el efecto de la temperatura y la duración de la reticulación en su composición. Después de probar el producto posterior en busca de contaminación microbiana, Se confirmó que la temperatura durante el proceso de fabricación era eficaz para la esterilización por calor seco. Pruebas adicionales mostraron cómo la composición única de aminoácidos de la proteína recombinante contribuyó a su robusta eficiencia de reticulación hidrotermal. A continuación, el equipo optimizó el material de proteína recombinante para el injerto óseo mediante la regulación de la concentración del material polipeptídico y su temperatura de congelación en función del volumen de hueso inducido por el injerto en un modelo de defecto óseo calvario (cráneo) de rata. Cuatro semanas después de injertar el material en el modelo animal, el equipo utilizó una estimación del volumen óseo basada en micro tomografía computarizada (micro CT). Los resultados indicaron una concentración óptima de 7.5 por ciento de RCPhC1, una temperatura de congelación de -40 a -60 grados Celsius, y reticulación deshidrotérmica a 130 ° C durante 7 horas para que sea la más adecuada para la fabricación de material de injerto óseo recombinante.
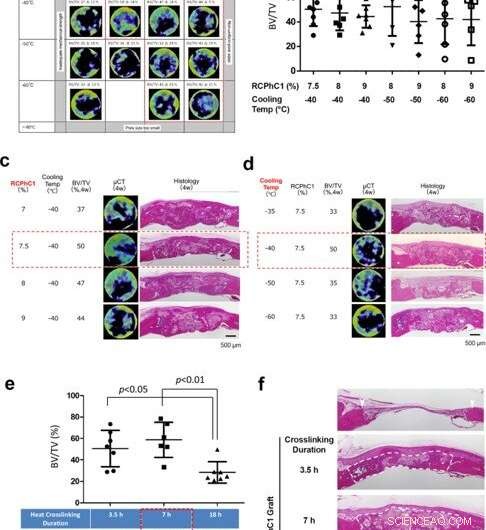
Optimización de factores de control de ingeniería. (a) Optimización de factores combinados de concentración de soluto RCPhC1 y temperatura del bloque TLFC, con la reticulación deshidrotermal tentativa a 130 ° C durante 7 h. El rango óptimo se redujo a la concentración de RCPhC1 entre 7,5 y 9% y la temperatura del bloque TLFC entre -40 y -60 ° C (bloque de puntos rojos). (b) Mediciones de BV / TV dentro del grupo del rango óptimo de concentración de RCP1C1 y temperatura de enfriamiento. No hubo diferencia estadística entre los grupos. (c) El efecto de la concentración de soluto RCPhC1 sobre la regeneración ósea. La barra de escala equivale a 500 μm. (d) El efecto de la temperatura del bloque TLFC sobre la regeneración ósea. La barra de escala equivale a 500 μm. (e) El efecto de la duración de la reticulación deshidrotermal sobre la formación de hueso. (n =7; prueba de comparación múltiple de Tukey) (f). El efecto de la duración de la reticulación deshidrotérmica sobre el mantenimiento del espacio de cicatrización de heridas en el defecto óseo calvarial de rata. Las puntas de flecha blancas muestran bordes defectuosos. Las líneas de puntos blancos rodean el tejido recién formado. La barra de escala equivale a 500 μm. Líneas horizontales en b, ye representa la media ± s.d. Crédito:Nature Communications Materials, doi:10.1038 / s43246-020-00089-9
Regeneración robusta de tejido óseo vital en modelos preclínicos con materiales de injerto
Basado en las condiciones óptimas verificadas experimentalmente, Fushimi y col. fabricó los injertos óseos RCPhC1 con gránulos porosos. Usando el modelo de defecto óseo calvarial de rata, demostraron cómo el injerto óseo inducía robustamente la regeneración ósea dentro de la estructura de los poros internos, mientras se degrada gradualmente in vivo, para indicar biocompatibilidad y biointegración efectiva. Compararon este resultado con un xenoinjerto de hueso esponjoso descelularizado bovino (vaca) comercialmente disponible y no observaron una regeneración ósea significativamente mayor. Luego, el equipo probó el material de injerto óseo en un modelo preclínico canino de extracción de dientes para comprender la cicatrización de heridas en la cavidad del diente. donde la cavidad de extracción tratada con el injerto óseo mostró una mejor formación ósea a las 12 semanas. En este momento, como se esperaba, el injerto óseo fue reemplazado en gran parte por tejido óseo.
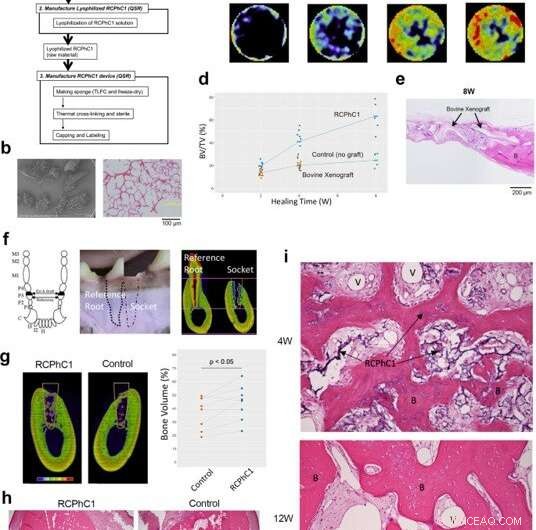
Ensayo preclínico de eficacia del material RCPhC1 optimizado para injerto óseo en modelos de roedores y caninos. (a) Diagrama de flujo del proceso de fabricación del injerto óseo RCPhC1. La barra de escala equivale a 100 μm. (b) El injerto óseo RCPhC1 se preparó como gránulos porosos de tamaño 300-1200 µm para un mejor manejo. La barra de escala equivale a 100 μm. (c) Transcurso de tiempo de la regeneración ósea inducida por injerto óseo RCPhC1 en el modelo de defecto calvarial de rata. El análisis histológico (fila superior) reveló tejido óseo recién formado (B) dentro del material de injerto RCPhC1, que fue reabsorbido con el tiempo. Una serie de evolución temporal de microCT in vivo (fila inferior) describió el aumento progresivo del tejido óseo. (d) Evolución temporal de la medición de BV / TV del defecto óseo calvarial de rata implantado con injerto óseo RCPhC1, xenoinjerto de hueso esponjoso descelularizado bovino y sin control de injerto. (e) Evaluación histológica de xenoinjerto bovino implantado en defecto óseo calvarial de rata. La estructura física del xenoinjerto bovino era similar a la del injerto óseo RCPhC1. En la periferia del defecto, Se observó un xenoinjerto bovino fusionado con el hueso recién formado (B). En el centro del defecto, Los gránulos de xenoinjerto bovino estaban rodeados de tejido fibroso. La barra de escala equivale a 200 μm. (f) Modelo de extracción de dientes caninos. El tercer premolar canino (P3) tiene raíces mesiales y distales casi idénticas. El tercer premolar fue semiseccionado y solo se extrajo la raíz distal. Un lado de la cavidad ósea posterior a la extracción se llenó con RCPhC1 mientras que el otro lado se dejó curar sin ningún tratamiento adicional. La raíz medial restante se trató endodónticamente y sirvió como referencia. La barra de escala equivale a 4 mm. (g) Corte transversal de MicroCT que muestra la regeneración ósea en la cavidad de extracción (línea blanca) después de 12 semanas (12 W) de curación. El volumen óseo dentro de la cavidad fue significativamente mayor en la cavidad implantada con injerto óseo RCPhC1 que en la cavidad de control no tratada (n =8; prueba t emparejada de dos lados). La barra de escala equivale a 4 mm. (h) Corte transversal histológico de la cavidad de extracción (línea blanca) a 12 W. La cavidad que recibió el injerto óseo RCPhC1 exhibió una mayor regeneración ósea. Las líneas blancas punteadas muestran las interfaces de los enchufes. La barra de escala es igual a 1 mm. (i) Evaluación histológica de la regeneración ósea asociada al injerto óseo (I) de RCPhC1. Se observó abundante formación vascular (II) en el tejido de la médula ósea de hueso en regeneración (III) después de 4 semanas (4 W) de curación. El injerto óseo RCPhC1 se reabsorbió en gran medida después de 12 W de cicatrización. El hueso regenerado contenía osteocitos vitales (IV). Crédito:Nature Communications Materials, doi:10.1038 / s43246-020-00089-9
Perspectiva de los andamios sintéticos en la ingeniería de tejidos óseos
De este modo, Hideo Fushimi y sus colegas optimizaron un sencillo pero un proceso de ingeniería crítico para regular la concentración de soluto de un polipéptido recombinante de la proteína de la cadena alfa I del colágeno tipo I humano con sustituciones de aminoácidos dirigidas, abreviado como RCPhC1. El equipo primero implantó la construcción en un modelo de defecto óseo calvarial de rata para comprender los factores de ingeniería óptimos para fabricar el injerto óseo. Diseñaron el material de injerto óseo para apoyar la migración de células madre mesenquimales (MSC) hacia el área del defecto y proporcionaron un microambiente estimulante para la diferenciación osteogénica. El material de injerto óseo solo mostró un patrón de curación ideal en ausencia de factores de crecimiento y células madre para regenerar el hueso. El material se puede utilizar para generar dispositivos médicos específicos de tejido y andamios de injerto con una versatilidad de fabricación significativa en la ingeniería de tejido óseo.
© 2020 Science X Network