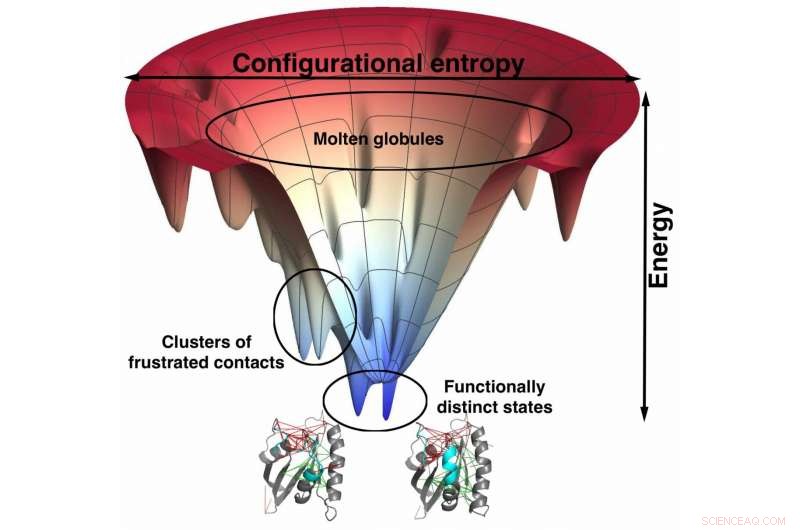
Los modelos a escala de átomos de los científicos de la Universidad de Rice basados en los utilizados para predecir cómo se pliegan las proteínas muestran una fuerte correlación entre los sitios de unión mínimamente frustrados y la especificidad del fármaco. El embudo una representación visual del paisaje energético de la proteína a medida que se pliega, ayuda a localizar esos sitios frustrados. Tales modelos podrían conducir a medicamentos mejor diseñados con menos efectos secundarios. Crédito:Mingchen Chen / Rice University
Saber con precisión dónde se frustran las proteínas podría contribuir en gran medida a producir mejores medicamentos.
Ese es uno de los resultados de un nuevo estudio realizado por científicos de la Universidad de Rice que buscan los mecanismos que estabilizan o desestabilizan secciones clave de biomoléculas.
Modelos a escala atómica del teórico de Rice Peter Wolynes, El autor principal y alumno Mingchen Chen y sus colegas del Centro de Física Biológica Teórica muestran que no solo son necesarias algunas secuencias frustradas específicas en las proteínas para permitirles funcionar, localizarlos también ofrece pistas para lograr una mayor especificidad para los fármacos.
Ese conocimiento también podría ayudar a diseñar medicamentos con menos efectos secundarios, Dijo Wolynes.
El estudio de acceso abierto del equipo aparece en Comunicaciones de la naturaleza .
Los modelos a escala de átomo se centran en las interacciones dentro de los posibles sitios de unión en lugar de en la gran mayoría de las interacciones en las proteínas que guían su plegamiento. Los modelos de resolución más fina permiten la incorporación de cofactores como ligandos químicamente activos, incluyendo moléculas de fármacos. Los investigadores dicen que esta capacidad brinda una nueva perspectiva de por qué los ligandos se capturan mejor solo por proteínas específicas y no por otras.
"Ligandos antinaturales, "también conocido como drogas, tienden a unirse mejor con esas bolsas frustradas en proteínas que se frustran mínimamente una vez que los medicamentos se unen, Dijo Wolynes. Tener una forma de encontrar y luego conocer los detalles de estos sitios mínimamente frustrados ayudaría a las compañías farmacéuticas a eliminar muchas pruebas y errores.
"La forma estándar de diseñar medicamentos es probar 10, 000 sitios de unión en una proteína para encontrar los que encajen, "Dijo Wolynes." Estamos diciendo que no tienes que probar todos los sitios de unión posibles, solo un número razonablemente justo para comprender las estadísticas de lo que podría funcionar en los entornos locales.
"Es la diferencia entre realizar una encuesta y tener una elección, ", dijo." La encuesta es más barata, pero aún tendrás que comprobar las cosas ".
Los investigadores de Rice son conocidos por su teoría del paisaje energético de cómo se pliegan las proteínas. Por lo general, emplea modelos de grano grueso en los que los aminoácidos están representados por solo unos pocos sitios.
Esa estrategia requiere menos potencia de cálculo que tratar de determinar las posiciones en el tiempo de cada átomo en cada residuo, y, sin embargo, ha demostrado ser muy preciso para predecir cómo se pliegan las proteínas en función de sus secuencias. Pero para este estudio, los investigadores modelaron proteínas y complejos proteína-ligando a nivel atómico para ver si podían encontrar cómo la frustración da a algunas partes de una proteína la flexibilidad necesaria para unirse a otras moléculas.
"Una de las mejores cosas del modelado en la resolución de todos los átomos es que nos permite evaluar si las moléculas del fármaco encajan bien en los sitios de unión o no, ", Dijo Wolynes." Este método es capaz de mostrar rápidamente si un sitio de unión para un determinado fármaco se frustrará mínimamente o seguirá siendo una región frustrada ". Si después de que la molécula se une, el sitio permanece frustrado, la proteína podría reorganizarse o el fármaco podría cambiar su orientación de tal manera que podría dar lugar a efectos secundarios ".
Modelar los sitios frustrados y, a veces, alterarlos para ver qué sucedería, permite a los investigadores ver cómo la especificidad del fármaco se correlaciona con las bolsas de unión. Análisis de frustración, ellos escribieron, proporciona "una ruta para la detección de compuestos más específicos para el descubrimiento de fármacos".
"Este concepto de frustración estaba presente desde el principio de nuestro trabajo sobre el plegamiento de proteínas, ", Dijo Wolynes." Cuando lo aplicamos a moléculas de proteínas reales, encontramos algunos ejemplos donde el mecanismo de plegado violó lo que predeciríamos de un embudo perfecto. Luego descubrimos que estas desviaciones de la imagen del embudo ocurrieron donde estaba la proteína, De hecho, algo frustrado.
"Fue como la excepción que confirma la regla, ", dijo." Algo que es cierto todo el tiempo puede ser trivial. Pero si no es cierto el 1% de las veces, es un problema por resolver, y hemos podido hacerlo con AWSEM, nuestro software de predicción de estructuras ".
Es posible extender el software para analizar la frustración a nivel atómico, como lo describe el grupo en otro artículo reciente. Pero el costo computacional de rastrear cada átomo en una proteína es tan alto que los investigadores necesitaban una forma de muestrear los movimientos de regiones específicas donde la frustración podría confundir la ruta de plegado.
"Mingchen se dio cuenta de que había un algoritmo eficiente para muestrear los entornos locales en los sitios de enlace, pero manteniendo la resolución atomística, "dijo Wolynes, quien notó que él y Chen, ahora en la industria privada, están utilizando los modelos para investigar posibles terapias, incluidos los medicamentos relacionados con COVID-19.