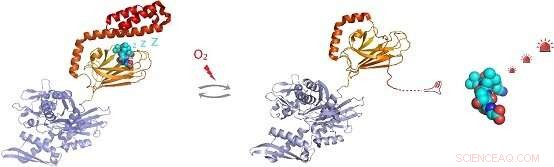
Figura:En condiciones de estrés oxidativo, la chaperona molecular Hsp70 sufre una modificación postraduccional de residuos de cisteína mediante la adición del tripéptido glutatión. La glutationilación dentro del dominio de unión al sustrato de Hsp70 hace que la región helicoidal C-terminal de Hsp70 se deshaga y ocupe su propio sitio de unión al sustrato. Esto evita la unión, permitiendo la activación de sustratos de moléculas de señalización como el factor de transcripción de choque térmico Hsf1. Crédito:grupo de la Dra. Sarah Perrett
Proteína de choque térmico 70 (Hsp70) Las proteínas son una familia de chaperonas moleculares antiguas y conservadas. Desempeñan un papel esencial en el mantenimiento de la homeostasis de las proteínas, incluida la facilitación del plegamiento y la degradación de proteínas, prevenir la agregación de proteínas, y participar en la respuesta al estrés. La interrupción de la maquinaria de control de calidad celular está asociada con el envejecimiento, cáncer y enfermedades neurodegenerativas.
El papel de las modificaciones postraduccionales (PTM) en la regulación de las funciones de Hsp70 es un campo de investigación emergente. Aunque el estrés oxidativo puede ser dañino, La variación redox es una característica natural del entorno celular y facilita la transducción de señales para importantes actividades fisiológicas. Las modificaciones de cisteína de las proteínas proporcionan el medio principal para la transferencia de señales redox. La glutationilación es una modificación reversible de los residuos de cisteína en las proteínas, que puede proteger las proteínas de la oxidación irreversible, y también puede desempeñar un papel en la transducción de señales.
En este estudio, Se detectó glutationilación de diferentes miembros de la familia Hsp70 en células HeLa y los sitios de modificación fueron determinados por espectrometría de masas por investigadores de la Prof. Sarah Perrett y el grupo del Prof. Chen Chang en el Instituto de Biofísica de la Academia China de Ciencias.
Centrándose en el estrés inducible Hsp70 HspA1A (hHsp70), Se investigó el mecanismo estructural detallado de cómo la glutationilación afecta la actividad de las proteínas y las interacciones proteína-proteína.
La detección in vivo mostró que cada uno de los cinco residuos de cisteína de hHsp70 puede sufrir glutatión. Los experimentos in vitro revelaron que la modificación de las cisteínas en el dominio de unión a nucleótidos de hHsp70 se evita mediante la unión de nucleótidos, pero que Cys-574 y Cys-603, ubicado en la tapa helicoidal α C-terminal del dominio de unión al sustrato, puede sufrir glutationilación tanto en presencia como en ausencia de nucleótidos.
Al resolver la estructura de RMN de la forma glutatiónilada de la hHsp70 SBD, Se demostró la base estructural de los cambios funcionales. La glutationilación de estos residuos de cisteína da como resultado el despliegue de la estructura de la tapa helicoidal α. La región desplegada imita el sustrato al unirse y bloquear el sitio de unión del sustrato, promoviendo así la actividad intrínseca de la ATPasa, y competir con la unión de sustratos externos. Esto conduce a una reducción en su capacidad para unirse a otras proteínas de sustrato, como el factor de choque térmico Hsf1.
Estos resultados indican no solo que la modificación de la cisteína puede alterar la estructura y función de hHsp70, pero también que hHsp70 puede transferir información redox a sus clientes.
Este estudio fue publicado en la Revista de química biológica el 12 de junio de 2020.