El nitruro de lantano (LaN) cargado de níquel permite una síntesis de amoníaco estable y altamente eficiente. Las vacantes de nitrógeno se generan en LaN con baja energía de formación, y se unen y activan eficazmente N2. Crédito:Tecnología de Tokio
Amoníaco (NH 3 ) es uno de los productos químicos más comúnmente producidos en todo el mundo, debido a su uso como ingrediente importante en una amplia gama de procesos de fabricación industrial. Por ejemplo, es fundamental en la producción de fertilizantes, y más de 150 millones de toneladas se aplican cada año para aumentar los rendimientos de varios cultivos. El amoníaco es producido naturalmente por muchos organismos vivos, pero sintetizándolo artificialmente usando nitrógeno (N 2 ) e hidrógeno (H 2 ) es un desafío porque el fuerte enlace entre los átomos de N es difícil de romper.
Mientras que un método para producir NH 3 a escala industrial, llamado el proceso de Haber-Bosch, ha existido desde principios del siglo XX, El enfoque de mejor rendimiento actual implica el uso de rutenio, un metal caro y escaso, como catalizador para desencadenar las reacciones necesarias. Recientemente, El profesor Hideo Hosono y sus colegas del Instituto de Tecnología de Tokio (Tokyo Tech), Japón, han desarrollado una nueva estrategia para producir NH 3 usando lantano (La), un elemento mucho más abundante, en combinación con níquel (Ni).
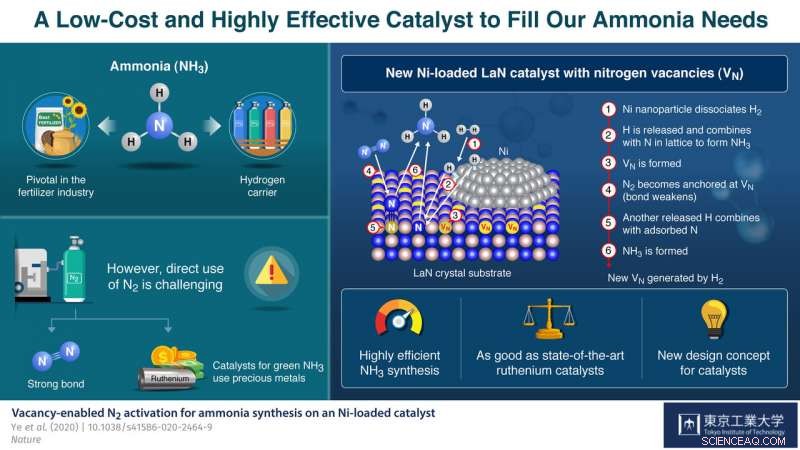
En su papel publicado en Naturaleza , explican cómo se inspiraron en un NH previamente informado 3 catalizador de producción con la fórmula Co 3 Mes 3 NORTE, que contiene vacantes de nitrógeno, lugares donde se esperaría la presencia de un átomo de nitrógeno pero que en realidad están vacíos. Estas vacantes se observaron para hacer la división de N 2 moléculas más fáciles, lo que llevó al equipo de Hosono hacia una nueva dirección de exploración para obtener NH más fácilmente disponibles y efectivos 3 catalizadores de síntesis. Explica:"El papel fundamental de las vacantes de nitrógeno en Co 3 Mes 3 N nos inspiró a considerar otros materiales que contienen nitrógeno en los que se podrían generar fácilmente vacantes como base para nuevos catalizadores a base de Ni ".
El catalizador que desarrollaron consiste en cristales de LaN cargados con nanopartículas de Ni. El Ni disocia fácilmente H 2 en átomos de H. Por lo tanto, pretratamiento del catalizador con H 2 genera fácilmente átomos de H, que luego reaccionan con los átomos de N en la estructura cristalina para formar NH 3 y crear N vacantes en el soporte de LaN. Cada uno de estos sitios vacíos captura un átomo de N de un N 2 molécula del gas nitrógeno de entrada, haciendo que el enlace N-N de la molécula se debilite. Otro átomo de H disociado rompe el enlace N-N debilitado para producir más NH 3 , dejando un átomo de N para llenar la vacante original. Estos ciclos se repiten generando así continuamente vacantes de nitrógeno y sosteniendo el proceso de síntesis.
Este concepto de un catalizador de "sitio activo dual" resultó ser muy prometedor. El rendimiento del catalizador propuesto supera con creces el de los catalizadores a base de cobalto y níquel más convencionales y es comparable incluso al de los basados en rutenio:no solo produce consistentemente altos rendimientos de amoníaco a temperatura y presión moderadas, su estructura se mantiene incluso después de 100 horas de reacción continua, demostrando su alta estabilidad.
Hosono dice:"Anticipamos que nuestro trabajo estimulará una mayor exploración de los diseños de catalizadores que hacen uso de elementos más abundantes. En particular, nuestros resultados ilustran el potencial de utilizar lugares vacantes en los ciclos de reacción y apuntan a un nuevo concepto de diseño de catalizadores para la síntesis de amoníaco ".
La nueva estrategia podría simplificar y hacer más asequible la producción de amoníaco. facilitando así una multitud de procesos industriales importantes.