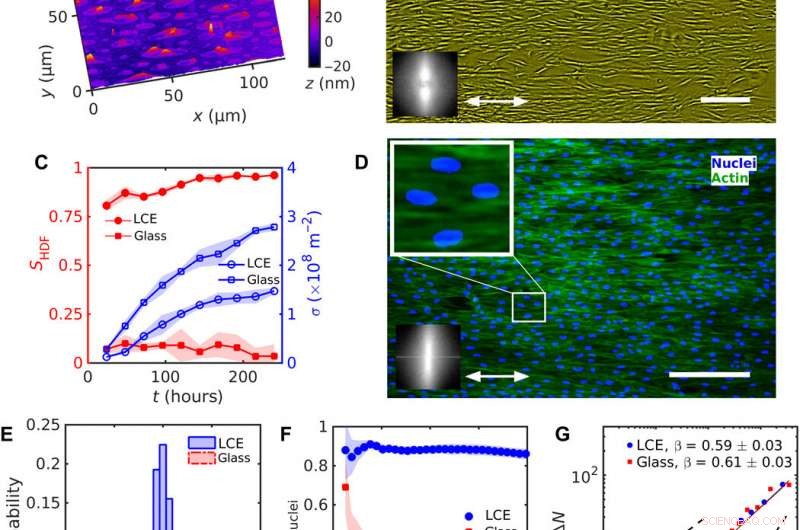
Alineación uniforme de células HDF en LCE con nˆLCE uniforme =const. (A) Textura de microscopía holográfica digital (DHM) de la superficie de LCE después del contacto con el medio de crecimiento acuoso. (B) Textura de microscopía de contraste de fase (PCM) de células HDF que crecen en sustratos LCE a las 120 horas después de la siembra. La flecha de dos puntas representa nˆLCE. (C) Evolución del parámetro de orden SHDF de los cuerpos de las celdas (símbolos rojos rellenos) y densidad celular σ (símbolos azules vacíos). (D) Texturas microscópicas fluorescentes de células HDF en LCE; núcleos marcados con fluorescencia (azul) y proteínas de actina F del citoesqueleto (verde). La textura ampliada muestra núcleos alargados orientados en la misma dirección que los cuerpos de las células. Los recuadros en (B) y (D) muestran la transformación rápida de Fourier de (B) PCM y (D) texturas fluorescentes de actina F que indican un orden de orientación a lo largo de la nˆLCE uniforme. (E) Distribución de la orientación de los núcleos. (F) Dependencia del parámetro de orden Snúcleos de núcleos del tamaño de una subventana cuadrada. (G) Fluctuaciones de densidad numérica ΔN calculadas para el número medio de núcleos celulares 〈N〉. Barras de escala, 300 micras. Crédito:Science Advances, doi:10.1126 / sciadv.aaz6485
Las células eucariotas dentro de los tejidos vivos pueden afectar procesos fisiológicos importantes como la apoptosis y la migración celular basados en la formación de patrones dinámicos con orientaciones que varían espacialmente. Sin embargo, Sin embargo, es un desafío proyectar un mapa prediseñado de orden de orientación en un tejido en crecimiento en el laboratorio. En un nuevo estudio ahora publicado en Avances de la ciencia , Taras Turiv y un equipo de investigación en física química, materiales avanzados y ciencias biomédicas en la Universidad Estatal de Kent, Ohio, NOSOTROS., detalló un nuevo enfoque para producir monocapas celulares de fibroblastos dérmicos humanos. Prediseñaron los patrones de orientación y los defectos topológicos utilizando un elastómero de cristal líquido fotoalineado (LCE) que se hinchó anisotrópicamente en un medio acuoso. El equipo inscribió los patrones en el LCE, y la monocapa de tejido replicó los patrones para causar fuertes variaciones en los fenotipos celulares (tamaño y forma), sus fluctuaciones de densidad superficial y densidad numérica. El nuevo enfoque puede controlar el comportamiento colectivo de las células en los tejidos vivos durante la diferenciación celular y la morfogénesis tisular para amplias aplicaciones en bioingeniería y medicina regenerativa.
Las células que constituyen tejidos vivos a menudo exhiben un orden de orientación cuando están en estrecho contacto debido a la alineación mutua de las células anisométricas. La dirección de la orientación promedio puede variar en el espacio y el tiempo para producir defectos topológicos conocidos como declinaciones. Dichos defectos pueden moverse dentro del tejido para desempeñar un papel importante durante los procesos y esfuerzos de compresión-dilatación. incluida la extracción de células muertas. La capacidad de diseñar un andamio de tejido de células vivas con control y orden de orientación es importante para los investigadores biomédicos a fin de investigar y manipular la materia viva. Los científicos ya han producido conjuntos de celdas ordenados en superficies fabricadas litográficamente, incluidos los bordes de los microcanales, en microsurcos y superficies con gradientes de rigidez del material. En este trabajo, Turiv y col. tejidos diseñados con un alto grado de orden de orientación y una dirección predeterminada que varía espacialmente, basado en una plantilla de patrones de director en sustratos LCE. El equipo utilizó células de fibroblasto dérmico humano (HDF) como unidades de construcción del tejido de plantilla.
Los granos de material sirven como guía para las células HDF. Crédito:Science Advances, doi:10.1126 / sciadv.aaz6485
Los fibroblastos son las células del tejido conectivo de mamíferos más comunes y, por lo general, mantienen una forma alargada y plana con funciones importantes durante la reparación y reestructuración de los tejidos. así como la cicatrización de heridas. Los científicos pueden reprogramar estas células en células madre pluripotentes para aplicaciones prometedoras en diagnóstico y terapia. En este trabajo, los efectos combinados de la siembra de células y la división de tejidos de HDF con patrón sobre sustratos de LCE prediseñados produjeron tejidos confluentes. El LCE estructurado tuvo un impacto marcado en el tejido, donde controlaban el patrón de alineación y la distribución espacial de las células, su densidad, fluctuaciones, y fenotipo. El LCE modelado mostró ubicaciones de defectos topológicos en tejidos a través de interacciones superficiales anisotrópicas en ubicaciones predeterminadas. Dado que la alineación celular y los defectos topológicos pueden controlar los procesos bioquímicos a microescala, este trabajo abre la posibilidad de diseñar superficies para patrones de tejido controlados con el fin de diseñarlas para funciones específicas.
Durante los experimentos, Turiv y col. sostuvo el sustrato LCE por una placa de vidrio y lo cubrió con óxido de indio y estaño (ITO) para reducir la rugosidad de la superficie, seguido de una capa de colorante azoico fotosensible y finalmente se cubrió el sustrato con un medio acuoso de cultivo celular. Los granos de la superficie del material sirvieron de guía para las células HDF. Cuando las células HDF se suspendieron en cultivo celular, parecían redondos pero después de asentarse en el sustrato, desarrollaron una apariencia alargada. Los científicos registraron los resultados de la confluencia (crecimiento) de los efectos combinados de la siembra celular. Los resultados mostraron que el orden de orientación se produjo debido a interacciones directas entre las células y el sustrato LCE. Los sustratos ayudaron a alinear tanto los cuerpos como los núcleos de las células HDF como una característica importante para muchas funciones celulares, incluida la expresión de proteínas, motilidad, metabolismo y diferenciación.

Alineación modelada de células HDF en LCE con un (-1/2, +1/2) par de defectos. (A) Textura de PolScope que muestra nˆLCE y retardo óptico de LCE en contacto con el medio de crecimiento celular. (B y C) Texturas DHM de la superficie de LCE en contacto con el medio de crecimiento celular con defectos (B) -1/2 y (C) +1/2. (D) Células HDF teñidas con fluorescencia; 4 ′, Núcleos de células marcadas con 6-diamidino-2-fenilindol (azul) y filamentos del citoesqueleto de actina marcados con faloidina (verde). (E) La densidad de superficie de los núcleos celulares σ en función de la distancia r de los núcleos defectuosos +1/2 (azul) y -1/2 (rojo). (F) Grandes fluctuaciones de densidad numérica ΔN de los núcleos en la vecindad de los núcleos defectuosos. (G) Imágenes PCM de células HDF en sustrato LCE a las 240 horas después de la siembra. Los puntos azules y rojos indican la ubicación de los núcleos defectuosos +1/2 y -1/2, respectivamente, obtenido de la textura de microscopía óptica polarizada (POM) de LCE. (H) Campo de orientación codificado por colores y (I) el esquema correspondiente del director de tejido HDF con patrón nˆHDF fotografiado con PCM. Las barras rojas en (I) denotan la orientación local de los ejes largos de las células. (J) Separación entre defectos de resistencia media para director horizontal y vertical entre ellos (ver fig. S6). Barras de escala, 300 micras. Crédito:Science Advances, doi:10.1126 / sciadv.aaz6485
The HDF cells on LCE self-organized into aligned assemblies following pre-imposed directions. The team noted the behavior of cells and cell density to vary as they approached defect cores and other topological inconsistencies (bent type defects or splay type defects) on the LCE substrates. The substrates markedly impacted the HDF cells that were in contact with each other, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
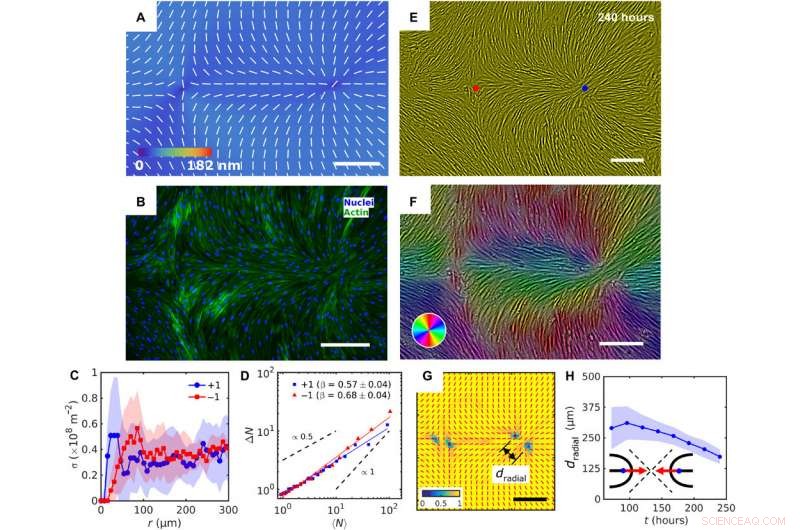
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Barras de escala, 300 μm. Crédito:Science Advances, doi:10.1126/sciadv.aaz6485
In this way, Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, diferenciación. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Crédito:Science Advances, doi:10.1126/sciadv.aaz6485
© 2020 Science X Network