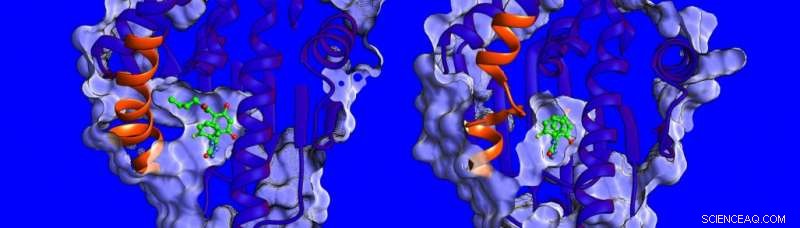
Diferencias en la estructura y dinámica de la región helicoidal (mostrada en naranja) de la proteína HSP90. Crédito:Instituto de Estudios Teóricos de Heidelberg
Un estudio conjunto de la industria y el mundo académico de una proteína diana del cáncer revela una relación inusual entre la flexibilidad del sitio de unión y la vida útil del fármaco diana. Los resultados, publicado en Comunicaciones de la naturaleza , sugieren una nueva estrategia para el descubrimiento de fármacos. La investigación se realizó en el marco del consorcio Kinetics for Drug Discovery K4DD, apoyado por la Iniciativa de Medicamentos Innovadores.
La mayoría de los fármacos ejercen su efecto terapéutico al unirse a una molécula de proteína diana, interfiriendo así con la función normal de la proteína. Tradicionalmente, Se ha considerado que cuanto más se une un fármaco a su proteína diana, es decir, cuanto mayor sea su afinidad de unión, más eficaz será. Sin embargo, las drogas deben funcionar en el entorno en constante cambio de los organismos vivos. Por lo tanto, se reconoce cada vez más que no solo la afinidad de unión y la termodinámica, pero también deben optimizarse los tiempos de residencia y la cinética del fármaco-objetivo durante el proceso de descubrimiento del fármaco.
Cinética puesta a prueba:estudiar un objetivo de cáncer
Un equipo multidisciplinario de científicos de los socios de K4DD Merck KGaA (Darmstadt), Instituto de Estudios Teóricos de Heidelberg (HITS), y el Instituto de Biologia Experimental e Tecnológica (iBET) (Lisboa), aplicaron enfoques experimentales y computacionales de última generación para investigar los determinantes de los tiempos de residencia del objetivo para un conjunto de inhibidores de un objetivo de cáncer ampliamente estudiado, proteína de choque térmico 90 (HSP90). Los inhibidores de HSP90 pueden interrumpir el ciclo celular y potencialmente detener el crecimiento tumoral. El equipo publicó recientemente algunos de sus resultados en Comunicaciones de la naturaleza .
Resultados sorprendentes:una mayor movilidad del sitio de unión conduce a tiempos de residencia más largos
"En este momento, se sabe poco acerca de los factores que influyen en los tiempos de residencia del fármaco-objetivo, por lo que decidimos medir la termodinámica y la cinética de unión, resolver las estructuras de complejos inhibidores de HSP90 y simular su dinámica, "dice la Dra. Marta Amaral, uno de los autores correspondientes. Las estructuras determinadas por cristalografía de rayos X muestran que el bolsillo de unión de HSP90 está revestido por una región que puede tomar la forma de una hélice o un bucle cuando se une a diferentes inhibidores (ver imagen a continuación).
Los investigadores encontraron que los compuestos que se unen con una hélice presente se unen durante más tiempo. "Nos sorprendió mucho, "dice la profesora Rebecca Wade (HITS), "cuando descubrimos que un contribuyente importante a los largos tiempos de residencia era la mayor movilidad de la región helicoidal del bolsillo de unión cuando el inhibidor se unía". Este mecanismo de unión inusual abre una nueva vía para el diseño de fármacos:los científicos pueden considerar objetivos de proteínas menos rígidos e identificar moléculas que estabilizan formas más móviles de la proteína al unirse, algo así como una bota de esquí con un forro interior adaptable que se ajusta continuamente al pie. Los hallazgos de este estudio sugieren una nueva forma de encontrar candidatos a fármacos más eficaces con propiedades cinéticas y termodinámicas óptimas.