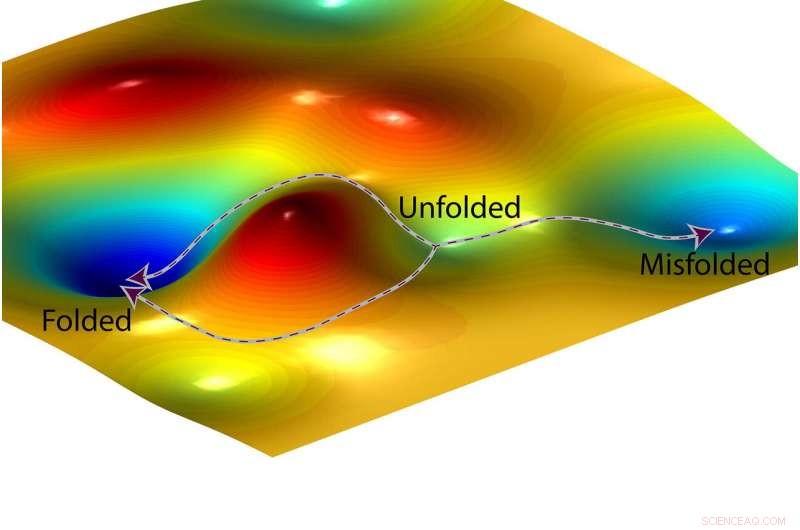
La representación de un artista de un paisaje de energía libre y dos posibles caminos que podría seguir una proteína (izquierda) para plegarse correctamente y un tercer camino (derecha) que conduce a un estado de plegado incorrecto. Crédito:O. Igoshin / Rice University
Los investigadores de la Universidad de Rice han descubierto una simetría oculta en las ecuaciones cinéticas químicas que los científicos han utilizado durante mucho tiempo para modelar y estudiar muchos de los procesos químicos esenciales para la vida.
El hallazgo tiene implicaciones para el diseño de fármacos, genética y la investigación biomédica y se describe en un estudio publicado este mes en el procedimientos de la Academia Nacional de Ciencias . Para ilustrar las ramificaciones biológicas, los coautores del estudio Oleg Igoshin, Anatoly Kolomeisky y Joel Mallory del Centro de Rice de Física Biológica Teórica (CTBP) utilizaron tres ejemplos de amplio alcance:plegamiento de proteínas, catálisis enzimática y eficiencia de las proteínas motoras.
En cada caso, los investigadores demostraron que una simple proporción matemática muestra que la probabilidad de errores está controlada por la cinética en lugar de la termodinámica.
"Podría ser una proteína que se pliega en la conformación correcta frente a la incorrecta, una enzima que incorpora el aminoácido correcto frente al incorrecto en la cadena polipeptídica, o una proteína motora que retrocede por error en lugar de avanzar, "dijo Igoshin, investigador del CTBP y profesor de bioingeniería en Rice. "Todas esas propiedades se pueden expresar como una relación de dos flujos de estado estacionario, y encontramos que las propiedades biológicas expresadas en estos términos están bajo control cinético ".
El ejemplo del plegamiento de proteínas ilustra las implicaciones para el diseño de fármacos. Todas las proteínas se pliegan en una forma característica, y una fracción mal plegada en la forma incorrecta. El plegamiento incorrecto de proteínas se ha relacionado con algunos trastornos y enfermedades genéticos hereditarios, y los fabricantes de medicamentos están interesados en fabricar medicamentos que puedan reducir las posibilidades de que las proteínas se doblen incorrectamente.
Antes de que se doble una proteína tiene energía, como una pelota en lo alto de una colina. Doblar es la carrera cuesta abajo desde este punto de partida de alta energía hasta el lugar donde la pelota deja de rodar. Los químicos a menudo usan una ayuda visual llamada "paisaje de energía libre" para trazar los niveles de energía en las reacciones químicas. El paisaje parece una cadena montañosa con picos y valles, y la carrera cuesta abajo desde el punto de partida desplegado de una proteína hasta su punto final completamente plegado puede parecer una carretera de montaña que serpentea a través de una serie de valles. Incluso si una ciudad a lo largo de la carretera tiene una elevación más baja, un viajero podría tener que subir colinas para pasar de un valle a otro en el camino cuesta abajo.
"Hemos demostrado que son las barreras los puntos altos entre valles, que determinan estos ratios, "Dijo Igoshin." Las profundidades de los valles no importan.
"Si desea obtener un medicamento que ayude a que una proteína se doble correctamente, por ejemplo, nuestra predicción es que el fármaco debe ser capaz de reducir una barrera a lo largo de la vía de plegado, ", dijo." Si solo afecta a los valles, digamos mejorando la estabilidad de algunas conformaciones intermedias a lo largo de la vía de plegado, no cambiará la proporción de veces que la proteína se pliega correctamente versus incorrectamente ".
Igoshin dijo que el trabajo surgió de un estudio de 2017 en el que él, Kolomeisky y el ex investigador postdoctoral del CTBP, Kinshuk Banerjee, demostraron que la precisión de la catálisis enzimática estaba controlada cinéticamente. Igoshin describió el descubrimiento como una "especie de simetría subyacente de ecuaciones".
"Si observa las proporciones de los flujos, obtienes esta interesante cancelación, y todos los términos que tienen que ver con estos valores se cancelan, y obtienes la invariancia, ", dijo." Cuando obtuvimos este resultado por primera vez, nos pareció contradictorio. Luego, no estábamos seguros de si fue una coincidencia, porque en el artículo anterior lo mostramos solo para dos esquemas cinéticos particulares. Ahora el trabajo de Joel ha demostrado que se puede generalizar a esta amplia gama de sistemas ".
Igoshin dijo que la simetría "no era tan difícil de probar, pero nadie lo había notado antes ".
"Creo que es un resultado físico muy interesante que tiene grandes implicaciones en biología, ", dijo." Podría ayudar a definir los límites de lo que es posible en términos de controlar y optimizar las propiedades a nivel del sistema en muchos procesos biológicos ".