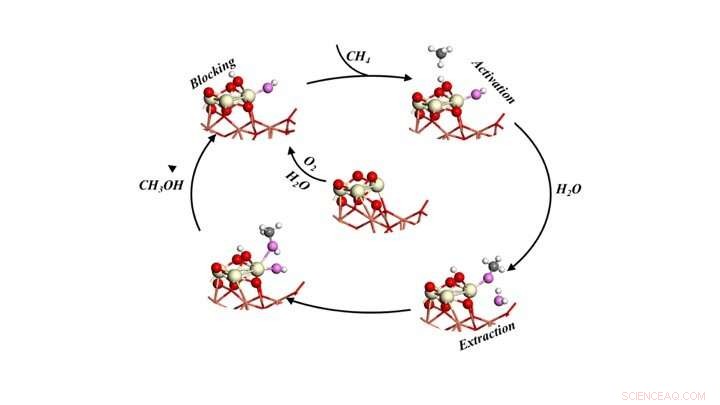
Ciclo catalítico para convertir selectivamente metano en metanol al exponer el metano a oxígeno y agua. Crédito:Laboratorio Nacional Brookhaven
Científicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. Y colaboradores han revelado nuevos detalles que explican cómo un catalizador altamente selectivo convierte el metano, el principal componente del gas natural, al metanol, un combustible líquido y una materia prima fáciles de transportar para la fabricación de plásticos, pinturas y otros productos básicos. Los hallazgos podrían ayudar al diseño de catalizadores aún más eficientes / selectivos para hacer de la conversión de metano una alternativa económicamente viable y ambientalmente atractiva para ventilar o quemar gas "residual".
Como se describe en un documento que aparece en Ciencias , el equipo utilizó modelos y simulaciones basados en la teoría para identificar los reordenamientos a nivel atómico que tienen lugar durante la reacción, y luego realizó experimentos para verificar esos detalles. Los estudios revelaron tres roles esenciales para el agua, trabajando en conjunto con un catalizador económico de óxido de cerio / óxido de cobre, para provocar la conversión de metano en metanol con una selectividad del 70 por ciento mientras se bloquean las reacciones secundarias no deseadas.
"Sabíamos por trabajos anteriores que habíamos desarrollado un catalizador altamente selectivo para la conversión directa de metano en metanol en presencia de agua, "dijo el químico de Brookhaven Lab Sanjaya Senanayake, quien lideró el proyecto. "Pero ahora, utilizando técnicas avanzadas teóricas y experimentales, hemos aprendido por qué funciona tan bien ".
Los hallazgos podrían acelerar el desarrollo de catalizadores que utilizan el metano que se escapa de los pozos de gas y petróleo. donde normalmente se ventila directamente a la atmósfera o se quema.
"Transportar gas es extremadamente difícil y potencialmente peligroso, "Dijo Senanayake." Pero si lo convierte directamente en un líquido, puede moverlo y usarlo en lugar de quemarlo derrochando ". Si bien el potencial de comercialización de tal reacción aún puede llevar varios años, esperamos que nuestros resultados y la comprensión de cómo funciona todo ayuden a llegar más rápido ".
La teoría sienta las bases
La búsqueda de catalizadores de metano a metanol ha revelado algunas perspectivas prometedoras. Pero muchos operan en varios pasos distintos con altos requisitos de energía. Y en muchos casos Las reacciones competitivas descomponen el metano (y cualquier metanol producido) completamente en monóxido de carbono (CO) y CO2. Entonces, cuando el equipo de Brookhaven observó por primera vez que su catalizador podía convertir directamente metano en metanol con alto rendimiento en una reacción continua, querían saber más sobre cómo realizaba esta difícil tarea.
Estaban particularmente interesados en descubrir el papel del agua, que pareció facilitar pasos clave en el proceso y de alguna manera bloquear las vías de reacción que producían CO y CO2.
Usando herramientas computacionales en el Centro de Nanomateriales Funcionales (CFN) de Brookhaven Lab, Centro de Computación y Datos Científicos de Brookhaven, Universidad de Stony Brook (SBU), y el Centro Nacional de Computación Científica de Investigación Energética (NERSC) en el Laboratorio Nacional Lawrence Berkeley del DOE (Berkeley Lab), El químico de Brookhaven, Ping Liu, desarrolló el enfoque teórico para averiguar qué estaba pasando.
Primero, usó cálculos de la "teoría funcional de la densidad" (DFT) para identificar cómo los reactivos (metano, oxígeno, y agua) cambiaron a medida que interactuaban entre sí y con el catalizador de óxido de cerio / óxido de cobre en varias etapas durante la reacción. Estos cálculos también incluyeron información sobre cuánta energía se necesitaría para pasar de una disposición atómica a la siguiente.
"La DFT le brinda un montón de 'instantáneas' de las etapas involucradas en la reacción y los 'baches' o barreras que debe superar para pasar de una etapa a la siguiente, " Ella explicó.
Luego realizó simulaciones de "Monte Carlo cinético", esencialmente usando computadoras para probar todas las formas posibles en que la reacción podría proceder de una instantánea a otra. Las simulaciones tienen en cuenta todas las posibles vías y los requisitos energéticos para pasar de una etapa a la siguiente.
"Estas simulaciones comienzan con cada etapa intermedia y analizan todas las posibilidades que pueden ir al siguiente paso, y descubren cuál es la vía más probable, "Dijo Liu." Las simulaciones determinan la forma más probable de conectar las instantáneas en tiempo real ".
Las simulaciones también modelan cómo las diferentes condiciones de reacción, por ejemplo, los cambios en la presión y la temperatura afectarán las velocidades de reacción y las vías probables.
"Había entre 45 y 50 componentes posibles en la 'red de reacción' que estábamos simulando, "dijo José Rodríguez, líder del grupo de catálisis de Brookhaven que también tiene una cita conjunta en SBU. "De esos, Silbido, Erwei Huang, y Wenjie Liao, dos Ph.D. estudiantes en SBU, fueron capaces de predecir cuáles serían las condiciones más favorables, el mejor camino, por pasar del metano al metanol y no al CO y al CO2, y todo inducido por la presencia de agua ".
Los modelos predijeron tres funciones para el agua:1) activar el metano (CH4) rompiendo un enlace carbono-hidrógeno y proporcionando un grupo -OH para convertir el fragmento CH3 en metanol, 2) bloquear los sitios reactivos que potencialmente podrían convertir el metano y el metanol en CO y CO2, y 3) facilita el desplazamiento del metanol formado en la superficie a la fase gaseosa como producto.
"Toda la acción tiene lugar en uno o dos sitios activos en la interfaz entre las nanopartículas de óxido de cerio y la película de óxido de cobre que componen nuestro catalizador, "Dijo Senanayake.
Pero esta descripción seguía siendo solo un modelo. Los científicos necesitaban pruebas.

Brookhaven Lab y Stony Brook University (SBU) miembros del equipo de investigación. Primera fila, de izquierda a derecha:Sanjaya Senanayake (Brookhaven), Mausumi Mahapatra (Brookhaven), José A. Rodríguez (Brookhaven), Ping Liu (Brookhaven) y Wenjie Liao (SBU). Segunda fila:Ivan Orozco (SBU), Ning Rui (Brookhaven), Zongyuan Liu (Brookhaven) y Erwei Huang (SBU). Crédito:Laboratorio Nacional Brookhaven
Los experimentos proporcionan pruebas
Para reunir pruebas, los científicos de Brookhaven y SBU realizaron experimentos adicionales en los laboratorios de la División de Química de Brookhaven y realizaron varios viajes a la Fuente de Luz Avanzada (ALS) en Berkeley Lab. Este equipo incluyó SBU Ph.D. el estudiante Ivan Orozco y los becarios postdoctorales Zongyuan Liu, Robert M. Palomino, Ning Rui, y Mausumi Mahapatra.
En la ALS, El grupo trabajó con Slavomir Nemsak de Berkeley Lab y los colaboradores Thomas Duchon (Peter-Grünberg-Institut en Alemania) y David Grinter (Diamond Light Source en el Reino Unido) para realizar experimentos utilizando espectroscopía de fotoelectrones de rayos X (XPS) a presión ambiental (AP). , lo que les permitió rastrear la reacción tal como sucedió en tiempo real para identificar pasos clave e intermedios.
"Los rayos X excitan electrones, y la energía de los electrones te dice qué especies químicas tienes en la superficie y el estado químico de las especies. Hace una 'huella dactilar química' ", dijo Rodríguez." Con esta técnica, puede seguir la química de la superficie y el mecanismo de reacción en tiempo real ".
La ejecución de la reacción con y sin agua en una variedad de condiciones confirmó que el agua desempeñaba los tres roles predichos. Las mediciones mostraron cómo las condiciones de reacción hicieron avanzar el proceso y maximizaron la producción de metanol al prevenir reacciones secundarias.
"Encontramos evidencia directa de la formación de CH3O, un precursor intermedio del metanol, en presencia de agua, Rodríguez dijo. Y porque tienes el agua, modificas toda la química de la superficie para bloquear las reacciones secundarias, y también libera fácilmente el metanol de la superficie del catalizador para que no se descomponga ".
"Ahora que hemos identificado los principios de diseño del catalizador, "Senanayake dijo, "A continuación, tenemos que construir un sistema real para usar tal catalizador y probarlo, y ver si podemos mejorarlo".