
¡Dobla tu propio nanocubo! Aunque los nanocubos utilizados en el proyecto de investigación se construyen solos, puedes doblar el tuyo usando este modelo. Cada X amarilla representa ubicaciones donde los investigadores de la Universidad de Tokio utilizaron diferentes átomos con diferentes niveles de polarización. Crédito:Shuichi Hiraoka, CC-BY-ND
El proceso de construcción de un cubo diminuto ha revelado algunos de los misterios fundamentales de cómo las moléculas se unen en entornos naturales. Los investigadores esperan aplicar este conocimiento a proyectos futuros que diseñen estructuras complejas que puedan imitar la vida.
Cuando dos moléculas rodeadas de agua se mueven una hacia la otra, parte de su atracción inicial se debe a veces a la fuerza química para repeler el agua:el efecto hidrofóbico.
Una vez que las moléculas están cerca unas de otras, pero aún no formalmente vinculado, una fuerza mucho más débil se vuelve importante:la fuerza de dispersión.
"Nuestro sueño es controlar la fuerza de dispersión y proporcionar un principio de diseño simple para utilizar la fuerza de dispersión para construir estructuras complejas de autoensamblaje, "dijo el profesor Shuichi Hiraoka, Líder del laboratorio donde se realizó la investigación en el Departamento de Ciencias Básicas de la Universidad de Tokio.
Las fuerzas de dispersión son un tipo de fuerzas de van der Waals, algunas de las interacciones químicas más débiles conocidas en la naturaleza. Aunque débil, las fuerzas de van der Waals son importantes; ayudan a los geckos a subir por las paredes y fueron identificados previamente en 2018 por el mismo grupo de investigación como uniendo las moléculas en forma de engranaje o copo de nieve de los nanocubos autoensamblados.
Midiendo la fuerza de dispersión en condiciones naturales, como cuando las moléculas están en solución con agua, ha sido imposible. La fuerza es tan débil que no se puede identificar por separado de las otras fuerzas en juego.
Sin embargo, en nuevos experimentos, el equipo de investigación utilizó sus nanocubos autoensamblados como herramientas para amplificar las diferencias en la fuerza de dispersión.
Las moléculas que forman los lados de los cubos se modificaron para contener átomos seleccionados por su polarizabilidad, es decir, su capacidad de respuesta al campo eléctrico circundante. Cada nanocubo completamente ensamblado contenía 18 de esos átomos polarizables.
El efecto combinado de 18 átomos fue suficiente para crear diferencias medibles en la fuerza de dispersión dependiendo de qué átomo polarizable estaba unido.
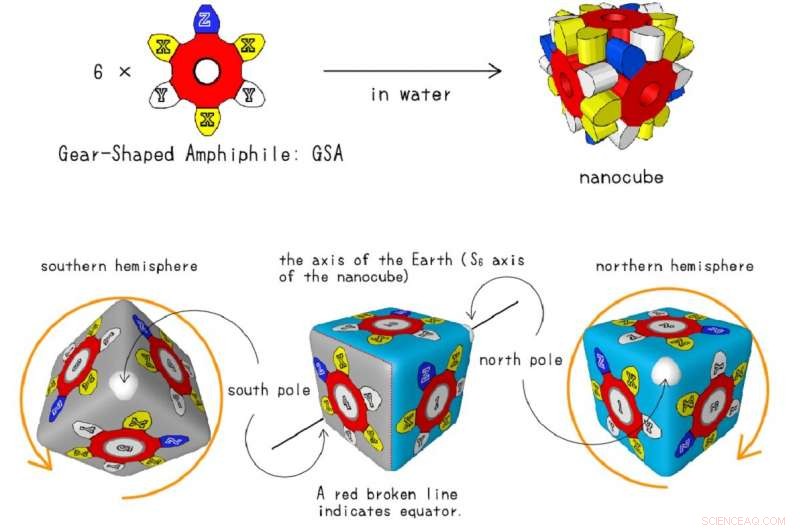
En esta ilustración se representa el nanocubo completamente ensamblado. Cada X amarilla es una ubicación donde los investigadores de la Universidad de Tokio utilizaron diferentes átomos seleccionados por su polarizabilidad. El efecto combinado de 18 átomos de polaridad variable en cada nanocubo permitió a los investigadores medir las diferencias en la fuerza de dispersión. Crédito:Shuichi Hiraoka, CC-BY.
La fuerza de dispersión se calcula matemáticamente después de usar una técnica llamada calorimetría de titulación isotérmica para medir la cantidad de calor liberado cuando las moléculas se unen.
Los átomos más polarizables crearon fuerzas de dispersión más fuertes e hicieron que los nanocubos fueran más estables. Dependiendo del valor estimado del efecto hidrofóbico, la fuerza de dispersión aporta 0,6 a 2,2 veces mayor fuerza de atracción y estabilidad al cubo que el efecto hidrofóbico.
Los investigadores planean utilizar este conocimiento sobre átomos más polarizables que crean fuerzas de dispersión más fuertes para diseñar futuras estructuras moleculares artificiales con formas más complejas y funciones aumentadas.
"Por ejemplo, podríamos diseñar moléculas con áreas de superficie de unión más grandes y colocar átomos polares a lo largo de los bordes para mejorar la estabilidad general a través de la atracción de las fuerzas de dispersión, "dijo Hiraoka.
Resolviendo un misterio en el diseño de fármacos
Hiraoka afirma que las medidas de los nanocubos construidos con hidrógeno normal en comparación con el deuterio, el isótopo "pesado" del hidrógeno, debe ser relevante para la teoría del diseño de fármacos. La investigación de otros grupos había dado lugar a informes contradictorios entre los químicos sobre si el intercambio de hidrógeno con el deuterio dos veces más pesado y más grande crearía una fuerza de dispersión más fuerte.
Como regla general, los átomos más grandes son más polarizables y los investigadores tenían nuevos datos que indicaban que una mayor polarización conducía a fuerzas de dispersión más fuertes. Sin embargo, en algunos casos, el hidrógeno más pequeño en realidad produce una fuerza de dispersión más fuerte que el deuterio pesado, pero otros informes mostraron la diferencia opuesta o insignificante entre los dos átomos.
"En nuestros experimentos, la diferencia de entropía-entalpía está completamente equilibrada. La energía libre liberada por los nanocubos con hidrógeno o deuterio es esencialmente idéntica, para que no haya diferencia entre ellos, "dijo Hiraoka.
Una diferencia esencial entre la investigación anterior y estos experimentos es que el equipo de UTokyo utilizó una condición más realista de estar en solución con agua y amplificó el efecto utilizando el diseño de nanocubos.