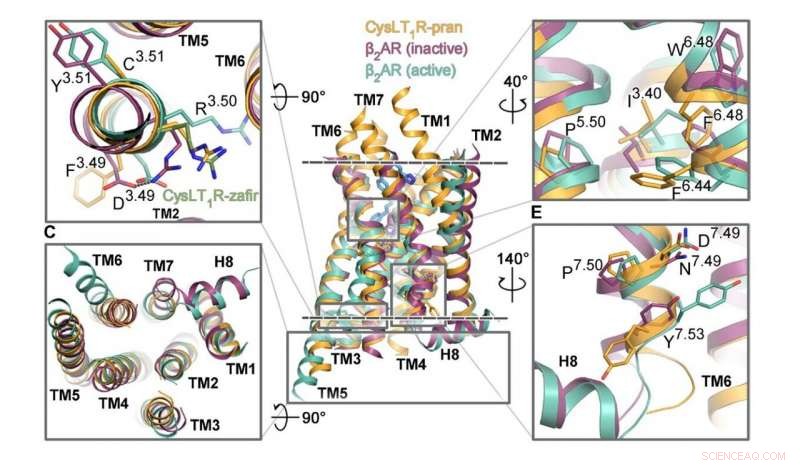
Los segmentos del receptor CysLT1 responsables de su activación se muestran en naranja, junto a otros receptores acoplados a proteína G. Crédito:Luginina et al./Science Advances
Un equipo de investigación del Centro MIPT de Mecanismos Moleculares del Envejecimiento y Enfermedades Relacionadas con la Edad ha colaborado con colegas de EE. UU. Canadá, Francia, y Alemania para determinar la estructura espacial del receptor CysLT1. El artículo fue publicado en Avances de la ciencia .
Receptores acoplados a proteína G, o GPCR, son máquinas moleculares incorporadas a las membranas celulares. Estos receptores captan señales específicas en el exterior de una célula y las transmiten a la célula. Las señales provienen de varias fuentes, incluyendo fotones de luz, moléculas de grasa, pequeñas proteínas, y fragmentos de ADN. Un GPCR puede desencadenar diversos eventos en la célula, como la división, reubicación, o incluso la muerte.
La "comunicación" celular mediada por GPCR es crucial para el funcionamiento de un organismo. No es de extrañar que estos receptores estén involucrados de alguna manera en todos los procesos de nuestro cuerpo. Son el objetivo de aproximadamente el 40% de los medicamentos existentes, también. Por lo tanto, Es interesante para los biólogos estructurales comprender el mecanismo de funcionamiento de estas máquinas biológicas y encontrar una forma de afectarlas. desarrollando nuevos fármacos que posean más especificidad y menos efectos secundarios.
La biología estructural es un campo interdisciplinario en la interfaz de la física y la biología, preocupado por el estudio de la disposición tridimensional de macromoléculas biológicas, como las proteínas. Los estudios estructurales involucran ingeniería genética, producción de proteínas artificiales, purificación, y cristalización. Una vez obtenido el cristal de proteína, La física entra en juego:los investigadores exponen el cristal de proteína a potentes rayos X para generar patrones de difracción. Los datos resultantes se pueden procesar matemáticamente para recuperar una estructura atómica 3D detallada de una molécula de proteína determinada, con una precisión de hasta varios angstroms.
Los estudios estructurales se basan en potentes fuentes de rayos X. Estos suelen ser de dos tipos:sincrotrones y láseres de electrones libres desarrollados más recientemente. En ambos casos, los electrones se aceleran casi a la velocidad de la luz. Luego se ven obligados a cambiar su velocidad o dirección de movimiento, que conduce a la emisión de rayos X. En un sincrotrón los electrones se mueven a lo largo de una curva, trayectoria casi circular. En un láser de electrones libres, viajan a través de un pasaje entre dos filas de imanes alternativos dirigidos de manera opuesta, conocido como ondulador.
Si bien los biólogos estructurales han utilizado sincrotrones desde la década de 1970, Los láseres de electrones libres son una adición relativamente reciente al conjunto de herramientas de cristalografía de proteínas. Introducido a principios de la década de 2010, generan una radiación extremadamente potente y permiten el análisis de difracción de rayos X de minúsculos cristales de 1 micrómetro. Este nuevo instrumento ya ha provocado el descubrimiento de varios cientos de estructuras.
Los investigadores de MIPT han investigado la estructura de un GPCR conocido como CysLT1. Está involucrado en procesos inflamatorios y juega un papel importante en las enfermedades alérgicas, incluido el asma, que afecta aproximadamente al 10% de la población mundial. El equipo de biofísicos obtuvo la estructura tridimensional detallada del receptor con las moléculas de zafirlukast y pranlukast. Estos son dos medicamentos recetados a pacientes con asma, rinitis alérgica, y urticaria.
Aunque relativamente grande, En el estudio se cultivaron cristales de 0,3 milímetros con pranlukast, los cristales con zafirlukast solo alcanzaron el tamaño de varios micrómetros. Las primeras muestras fueron investigadas en el sincrotrón ESRF en Grenoble, Francia. Estos últimos se examinaron utilizando la fuente de luz coherente Linac operada por la Universidad de Stanford, un láser de electrones libres. Los colegas de los investigadores de Canadá ayudaron a explorar los mecanismos de transmisión de señales a través de CysLT1.
"Estas son, sin duda, estructuras únicas, y nos hemos encariñado bastante con ellos, ", dijo la coautora del estudio, Aleksandra Luginina, del Laboratorio MIPT de Biología Estructural de Receptores Acoplados a Proteína G". El mecanismo de funcionamiento del receptor CysLT1 actualiza la forma en que vemos el funcionamiento de los subgrupos de proteínas GPCR. También, mediante la identificación de los sitios de unión para las moléculas de zafirlukast y pranlukast, sentamos las bases para mejorar los medicamentos para el asma, aumentando su eficacia y reduciendo los efectos secundarios ".
Los GPCR son objetos notoriamente difíciles para los estudios estructurales. Solo unos pocos laboratorios en todo el mundo han logrado completar proyectos de investigación de este tipo. El equipo de MIPT se alegra de que un laboratorio del Instituto se encuentre ahora entre ellos.