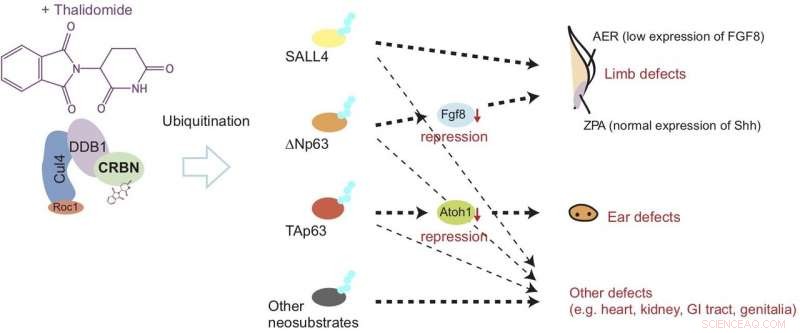
La talidomida se une al cereblon (CRBN) y provoca un desarrollo anormal de las extremidades y las orejas al inducir la degradación de las proteínas llamadas? Np63α y TAp63α a través de un proceso conocido como ubiquitinación. Este modelo sugiere que los defectos se desencadenan mediante la regulación a la baja de factores de crecimiento llamados Fgf8 y Atoh1. Crédito: Biología química de la naturaleza
Investigadores en Japón e Italia han profundizado la comprensión de la forma en que la talidomida causa anomalías en el desarrollo a nivel molecular. Un estudio internacional en coautoría de investigadores del Instituto de Tecnología de Tokio (Tokyo Tech) y la Universidad Médica de Tokio ha revelado una vista detallada de cómo la talidomida, una de las drogas más notorias jamás desarrolladas, provoca anomalías en el desarrollo de las extremidades y las orejas. Los hallazgos pueden contribuir al resurgimiento de seguros, o no teratogénico, Medicamentos derivados de la talidomida como tratamiento para el cáncer y las enfermedades inflamatorias.
Utilizado originalmente a finales de la década de 1950 como tratamiento para las náuseas matutinas, La evidencia a principios de la década de 1960 vinculaba la talidomida con anomalías que incluían miembros acortados y órganos defectuosos. lo que llevó a su prohibición en todo el mundo. Notablemente, basado en hallazgos posteriores que destacaron las propiedades antiinflamatorias y otras propiedades beneficiosas de la talidomida, el medicamento se ha convertido en un ejemplo importante de uno que puede reutilizarse para tratar afecciones como la lepra y el mieloma múltiple, un tipo de cáncer de sangre.
"La tragedia de la talidomida no es un caso abierto y cerrado en la historia médica, pero está en curso, dado que han nacido nuevos bebés con talidomida después de su reaprobación alrededor del año 2000, "explica el bioquímico Yuki Yamaguchi de Tokyo Tech." Pero ahora sabemos que la talidomida y sus fármacos derivados son muy eficaces y están asociados con pocos efectos secundarios, excepto por los efectos teratogénicos sobre el feto, a diferencia de muchos otros agentes anticáncer convencionales. Por lo tanto, la teratogenicidad sigue siendo un gran obstáculo para una aplicación más amplia de estos prometedores fármacos ".
Para investigar los mecanismos detrás de la actividad de la talidomida con más detalle, Yamaguchi colaboró con Hiroshi Handa de la Universidad Médica de Tokio, Luisa Guerrini de Universita degli Studi di Milano, Italia, y otros para realizar estudios de desarrollo utilizando el pez cebra como organismo modelo. Esta colaboración se propuso explorar la corazonada de Guerrini de que la familia de proteínas p63 podría estar críticamente involucrada. En 2010, un equipo dirigido por Handa y Yamaguchi logró un gran avance al identificar al cereblon como una proteína clave a través de la cual la talidomida inicia sus efectos adversos o teratogénicos.
Ahora, el último estudio publicado en Biología química de la naturaleza muestra que después de unirse al cereblon, la talidomida daña las aletas (correspondientes a las extremidades) y las vesículas óticas (correspondientes a las orejas) al inducir la degradación de dos tipos de proteína p63. Específicamente, el estudio sugiere que la descomposición de ΔNp63α da como resultado defectos en las extremidades, mientras que el de TAp63α conduce a defectos del oído, como se muestra en la Figura 1.
Comprender cómo funciona el cereblon para mediar los efectos de la talidomida podría transformar la forma en que se desarrollan los fármacos, alejándose del descubrimiento fortuito y hacia un diseño molecular racional. "El cambio sería como pasar de buscar una aguja en un pajar a tallar una aguja en un hueso, "Observa Yamaguchi.
"Es probable que veamos el desarrollo de nuevos fármacos basados en la talidomida sin efectos teratogénicos en un futuro próximo". " él dice.