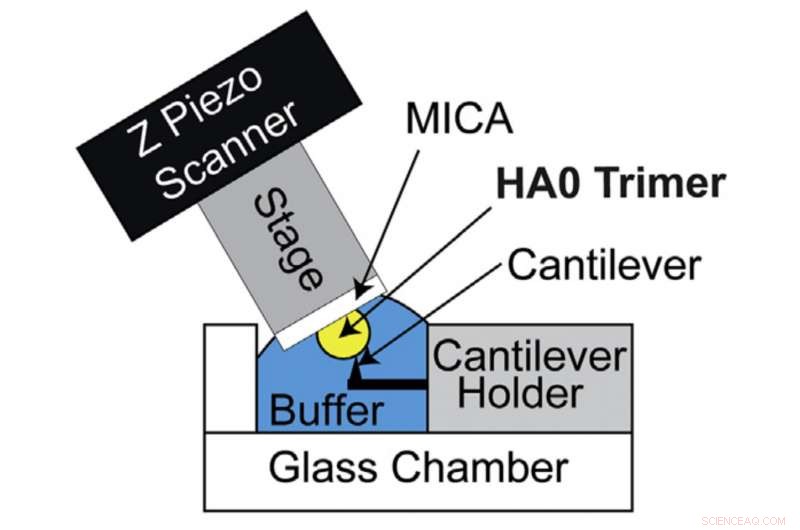
Configuración HS-AFM para visualización directa del trímero HA0. Diagrama esquemático de la configuración HS-AFM para escanear el trímero HA0. Crédito:Universidad de Kanazawa
Los virus de la influenza A, que son responsables de pandemias mortales en el pasado, sigue siendo un importante problema de salud pública mundial en la actualidad. Las moléculas conocidas como factores de virulencia son producidas por bacterias, virus y hongos para ayudarles a infectar las células huésped. Uno de los factores de virulencia que se encuentran en los virus de la influenza A es la hemaglutinina (HA). Investigadores de la Universidad de Kanazawa han estudiado recientemente la estructura de HA del virus de la influenza aviar, H5N1, utilizando microscopía de fuerza atómica de alta velocidad (HS-AFM). Sus hallazgos son esenciales para desarrollar enfoques terapéuticos contra los virus de la influenza A en el futuro.
La HA es sintetizada inicialmente por las células huésped en su forma precursora conocida como HA0. La conversión de HA0 en HA depende de la patogenicidad de los virus de influenza A:conversión extracelular para virus de influenza A de baja patogenicidad y conversión intracelular de virus de influenza A altamente patógenos. Por lo tanto, Comprender la estructura y las propiedades de HA0 es fundamental para descifrar HA. Por lo tanto, Richard Wong y su equipo de investigación buscaron analizar HA0 bajo el microscopio. La proteína HA0 recombinante de H5N1 se analizó visualmente mediante el sistema HS-AFM desarrollado por la Universidad de Kanazawa.
Tanto HA0 como HA existen en formas homotriméricas y la conversión de HA0 en HA no modifica significativamente la estructura homotrimérica. Por lo tanto, Es razonable utilizar HA como plantilla para generar imágenes de simulación HA0 HS-AFM. Un entorno endosómico ácido es el factor crítico para que HA induzca la fusión entre la membrana viral y la membrana endosómica para liberar materiales virales en las células huésped. Para dilucidar el efecto ácido sobre HA0, fue expuesto por primera vez a un ambiente ácido. El trímero de HA0 resultó ser muy sensible a la solución ácida y se expandió considerablemente. Cuando se midieron los cambios conformacionales de la hemaglutinina en tiempo real usando HS-AFM, el equipo descubrió que su área era más grande, y su altura más corta. El ambiente ácido esencialmente hizo que la molécula fuera más plana y circular, en comparación con su contraparte original. Este cambio de conformación fue, sin embargo, reversible ya que la estructura volvió a su forma original tras la neutralización.
Este estudio allanó el camino para la investigación de eventos biológicos dentro de los virus en tiempo real. Los autores afirman la importancia de HS-AFM para esta investigación:"Nuestro trabajo piloto establece HS-AFM como una herramienta inimitable para estudiar directamente la dinámica de las proteínas virales, que son difíciles de capturar con técnicas de baja relación señal-ruido que se basan en promedios de conjuntos, como la cristalografía de rayos X y cyro-EM, ", dice el autor principal del estudio, el Dr. Kee Siang Lim." Con una alta velocidad de exploración y un voladizo mínimamente invasivo, predecimos que HS-AFM es factible para revelar el flujo de cambios conformacionales irreversibles de HA2 inducidos por un pH bajo, que está imitando los verdaderos eventos biológicos que ocurren cuando HA ingresa al endosoma del huésped, en estudio futuro ".