Crédito:Universidad Estatal de Michigan
Las cianobacterias son diminutas, organismos resistentes. Cada celda es 25 veces más pequeña que un cabello humano, pero no dejes que el tamaño te engañe. Su capacidad colectiva para expandir la fotosíntesis es la razón por la que tenemos aire para respirar y una biosfera diversa y compleja.
Los científicos están interesados en lo que hace que las cianobacterias en expansión sean excelentes en la fotosíntesis. Algunos quieren aislar y copiar procesos exitosos. Aquellos luego serían reutilizados para uso humano, como en medicina o para energías renovables.
Uno de estos sistemas es ampliar la fotoprotección. Incluye una red de proteínas que detectan los niveles de luz circundantes y protegen a las cianobacterias de los terribles daños causados por la sobreexposición a la luz brillante.
El laboratorio de Cheryl Kerfeld descubrió recientemente una familia de proteínas, la proteína carotenoide helicoidal (HCP), quienes son los ancestros evolutivos de las proteínas fotoprotectoras actuales. Aunque antiguo, HCP todavía vive junto a sus descendientes modernos.
Este descubrimiento ha abierto nuevas vías para explorar la fotoprotección. Y por primera vez el laboratorio de Kerfeld caracteriza estructural y biofísicamente una de estas proteínas expansivas. Lo llaman HCP2. El estudio se encuentra en la revista BBA-Bioenergetics.
La ciencia
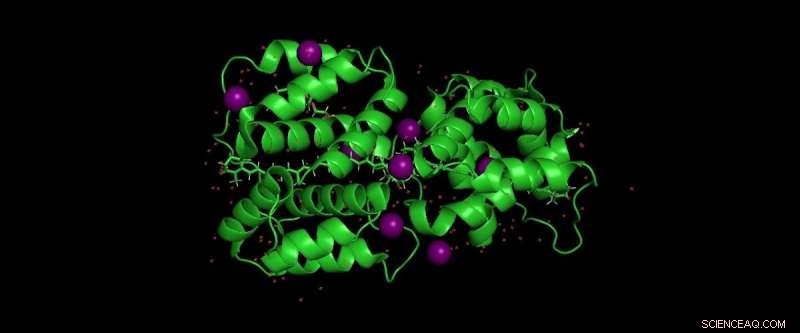
Estructuralmente el HCP2 es un monómero cuando se aísla en una solución. Pero, en su forma cristalizada expandida, curiosamente aparece como un dímero.
"No creemos que el dímero sea la forma de la proteína cuando está en las cianobacterias, "dice María Agustina (Tina) Dominguez-Martin, un postdoctorado en el laboratorio de Kerfeld. "Más probable, HCP2 se une a un socio aún desconocido. La situación del dímero durante la cristalización es artificial, porque las únicas moléculas disponibles en el medio ambiente son otras como él ".
Los científicos intentan determinar las funciones de HCP2. Es un buen extintor de expansión de especies reactivas de oxígeno, subproductos dañinos de la fotosíntesis. Pero dado que muchas otras proteínas también pueden hacer eso, Tina no cree que esa sea la función principal de HCP2.
"Aún tenemos que identificar una función principal, "Dice Tina." La dificultad es que la familia HCP es un descubrimiento reciente, así que no tenemos mucha base para comparar ".
Otros experimentos incluyen:
Aplicaciones futuras
La capacidad de detectar la luz es clave para las aplicaciones, especialmente en biotecnología. Un área prometedora es la optogenética, una tecnología que utiliza la luz para controlar las células vivas. Los sistemas optogenéticos son como interruptores de luz que activan funciones predeterminadas cuando son golpeados por una fuente de luz.
HCP2 podría desempeñar un papel en este tipo de aplicaciones. Pero todo esto está muy lejos.
"Hay 9 familias evolutivas de HCP para explorar. Eso se suma a cientos de variantes con funciones posiblemente distintivas que aún tenemos que descubrir, ", agrega." Con eso en mente, estamos caracterizando otras proteínas de la familia HCP para ampliar nuestro conjunto de datos disponibles ".
Debido a que estas proteínas probablemente juegan un papel en la fotoprotección, pueden representar un sistema que los científicos podrían diseñar para una "fotoprotección inteligente, "reduciendo la fotoprotección derrochadora que luego ayudaría a los organismos fotosintéticos a ser más eficientes".