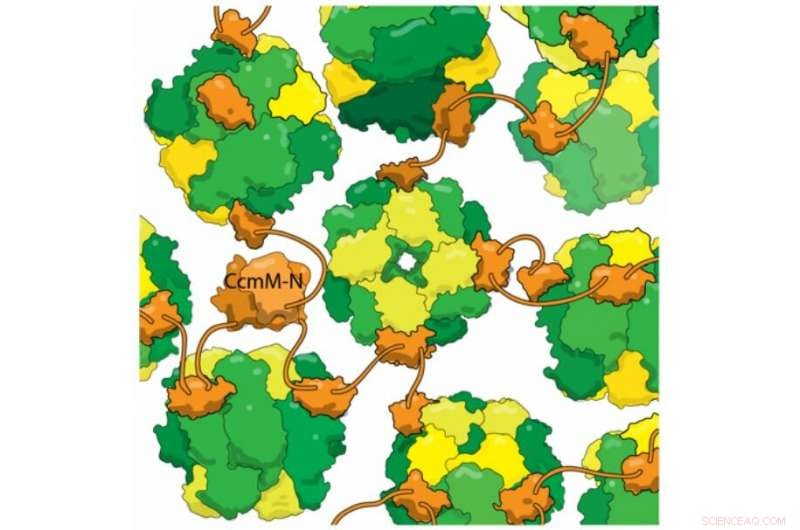
Nueva evidencia estructural muestra que la proteína cianobacteriana CcmM (naranja) se une a las enzimas RuBisCo completamente ensambladas (amarillo y verde) sin desalojar las subunidades RbcS (amarillo). Esta mezcla reticulada forma la base del carboxisoma, un compartimento de bacterias que se utiliza para evitar la fotorrespiración. La fotorrespiración es un paso inútil en la fotosíntesis causado cuando RuBisCo fija oxígeno en lugar de dióxido de carbono. y se cree que reduce el rendimiento de algunos cultivos en más del 20%. Atrapando dióxido de carbono en carboxisomas, las bacterias aumentan su concentración, ayudando a RuBisCo a fijar correctamente el CO2. Una mayor comprensión del ensamblaje de carboxysome puede ayudar a diseñar cultivos de mayor rendimiento en un futuro próximo.
Esta investigación aparece en el Revista de química biológica . Crédito:Ryan et al ., Revista de química biológica , 2019. (DOI:10.1074 / jbc.RA118.006330)
Los investigadores que enfrentan un futuro con una población más grande y un clima más incierto están buscando formas de mejorar los rendimientos de los cultivos. y están buscando bacterias fotosintéticas para soluciones de ingeniería.
En el Revista de química biológica , un equipo de investigación canadiense informa sobre cómo las cianobacterias logran uno de los pasos más derrochadores de la fotosíntesis. El estudio investigó el ensamblaje de carboxisomas en los que las bacterias concentran dióxido de carbono, aumentando la eficiencia de una enzima crítica llamada RubisCO.
"Básicamente, todo lo que comemos comienza con RubisCO, "dijo Matthew Kimber, profesor de la Universidad de Guelph en Ontario, Canadá, y autor principal del artículo reciente.
La enzima que está compuesto por 16 subunidades de proteínas, es fundamental para la fotosíntesis. Usando energía capturada de la luz, incorpora dióxido de carbono en moléculas orgánicas a partir de las cuales la planta genera azúcar nuevo. Desafortunadamente, no es terriblemente eficiente. O, desde el punto de vista de Kimber, "RubisCO tiene una tarea realmente ingrata".
La enzima evolucionó en un mundo antiguo donde el dióxido de carbono era común y el oxígeno escaso. Como resultado, no es muy exigente para discriminar entre los dos gases. Ahora que las tornas atmosféricas han cambiado, RubisCO a menudo captura accidentalmente oxígeno, generando un compuesto inútil que la planta luego tiene que invertir energía extra para reciclar.
Comparado con las plantas, las cianobacterias cometen muy pocos errores de este tipo. Esto se debe a que las bacterias acumulan su RubisCO en cuerpos densos conocidos como carboxisomas. Las bacterias bombean bicarbonato (simplemente CO2 hidratado) al interior de la célula; una vez que entra en el carboxysome, las enzimas convierten el bicarbonato en dióxido de carbono. Debido a que el dióxido de carbono no puede escapar a través de la capa de proteína que rodea al carboxisoma, se acumula a altas concentraciones, ayudando a RubisCO a evitar costosos errores.
El interés de Kimber en los carboxisomas radica principalmente en comprender la lógica de su organización. "En realidad, son máquinas extraordinariamente intrincadas, ", explica." La cianobacteria produce unas once proteínas de aspecto normal, y estos de alguna manera se organizan en este megacomplejo autorregulado que puede exceder el tamaño de una pequeña celda ".
Uno de los trucos más impresionantes de los carboxisomas es el autoensamblaje, que el laboratorio de Kimber se propuso entender. Miraron una proteína llamada CcmM, que acorrala las enzimas RubisCO en nuevos carboxisomas. Sabían que parte de CcmM se parece mucho a una subunidad de RubisCO, tanto que De hecho, que los investigadores sospechan que las cianobacterias antiguas crearon originalmente CcmM duplicando un gen RubisCO. La mayoría de los científicos en el campo creían que CcmM se une a la enzima usurpando el lugar de esa subunidad. Pero cuando el laboratorio de Kimber echó un vistazo detallado a CcmM, utilizando técnicas biofísicas para observar la estructura y unión de la proteína, los resultados mostraron que la sabiduría recibida estaba mal. Cierto, CcmM tenía una forma similar a la pequeña subunidad RubisCO. Pero los complejos que formó todavía incluían las 8 subunidades pequeñas, lo que significa que en lugar de robar un lugar de una subunidad RubisCO, CcmM tenía que ser vinculante en otro lugar por completo.
"Esto es muy extraño desde una perspectiva biológica, porque si CcmM surgió duplicando la subunidad pequeña, es casi seguro que originalmente se vinculó de la misma manera, ", Dijo Kimber." En algún momento, debe haber evolucionado para preferir un nuevo sitio de unión ".
Los investigadores también encontraron que un enlazador entre dominios de enlace en CcmM es lo suficientemente corto como para que "en lugar de envolver RubisCO, se une (enzimas individuales) como cuentas en una cuerda. Con varios enlazadores de este tipo uniendo cada RubisCO al azar, entrecruza todo en este gran globo; lo envuelves con un caparazón, y esto luego se convierte en el carboxysome ".
Científicos de una universidad diferente informaron el otoño pasado que habían logrado hacer plantas de tabaco con un carboxisoma reducido en sus cloroplastos. Esas plantas no crecieron especialmente bien, y los autores concluyeron que habían eliminado demasiados componentes del carboxisoma; aunque podría construirse en el cloroplasto, fue un lastre para las plantas en lugar de una ayuda. Tener una mejor comprensión de cómo las proteínas como CcmM contribuyen a la construcción y función del carboxisoma podría ayudar a los bioingenieros a aprovechar la eficiencia del carboxisoma en la próxima generación de plantas de ingeniería.