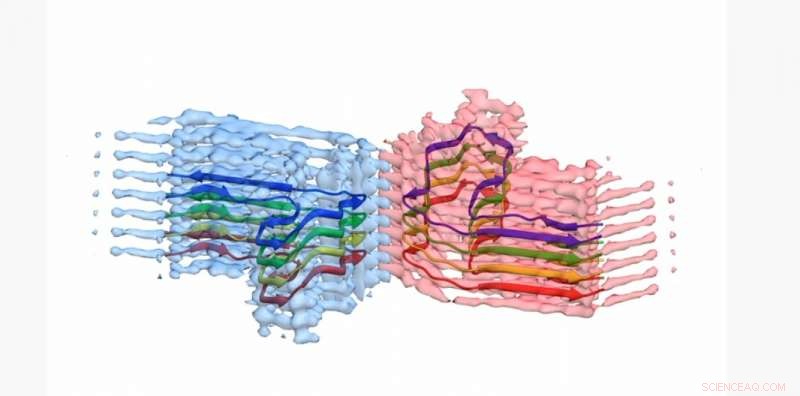
Una sección de una fibrilla de amiloide b2m, con el modelo atómico para 8 copias de la proteína b2m incorporada en la densidad EM. La fibrilla se construye a partir de dos 'protofilamentos' que se envuelven entre sí (azul y rosa). Esta sección tiene alrededor de 4 mil millonésimas de metro de largo Crédito:Universidad de Leeds
La misión centenaria de comprender cómo las proteínas responsables de enfermedades de base amiloide como el Alzheimer, El trabajo de Huntingdon y Parkinson ha dado importantes pasos hacia adelante en los últimos 12 meses, gracias a una revolución en una poderosa técnica de microscopía utilizada por los científicos.
Microscopios de alta potencia que utilizan electrones en lugar de luz para 'ver' la forma real de las muestras colocadas debajo de ellos. en niveles de detalle casi atómicos, sólo recientemente están disponibles para los científicos del Reino Unido.
El Reino Unido ha invertido mucho en los microscopios crioelectrónicos que cambian las reglas del juego, pero todavía hay menos de 25 de los instrumentos multimillonarios en universidades e institutos de investigación del Reino Unido.
Los dos instrumentos de la Universidad de Leeds, financiado por la propia Universidad y Wellcome, son los únicos de su tipo en el norte de Inglaterra.
Ya han demostrado su valor como herramienta clave para los científicos que los han utilizado en varios proyectos de investigación. pero acaban de lograr su mayor éxito hasta ahora:revelar la estructura del amiloide, una acumulación de proteínas anormales en el cuerpo que causa enfermedades.
Hay menos de 10 imágenes y estructuras de buena calidad de este tipo de proteínas disponibles para estudiar en el mundo. por lo que la investigación de Leeds hace una contribución significativa a la comprensión de los científicos sobre cómo las proteínas forman agregados y cómo podrían contribuir a la enfermedad amiloide.
Las imágenes y las estructuras tridimensionales de los agregados de proteínas, que los científicos de Leeds mostraron formaban largas, fibras retorcidas — se ha publicado en la revista Comunicaciones de la naturaleza . La proteína involucrada, la β2-microglobulina, normalmente está involucrada en un sistema inmunológico saludable, pero puede ensamblarse en las fibras amiloides que causan dolor en personas que se someten a diálisis a largo plazo por insuficiencia renal. Cuando se alojan en las articulaciones de las personas, pueden causar osteoartritis.
Se prevé que los resultados serán utilizados por fabricantes de medicamentos y grupos de investigación a nivel internacional que luchan por financiar curas para enfermedades amiloides de todo tipo.
Profesora Sheena Radford FMedSci, FRS y el profesor Neil Ranson del Centro Astbury de Biología Molecular Estructural de la Universidad, dirigió el programa de cinco años para obtener imágenes de las fibras proteicas y mostrar su estructura tridimensional.
La pareja fue apoyada por colegas en Leeds, Josh Boardman, quien en ese momento era estudiante de licenciatura en Bioquímica.

Dra. Rebecca Thompson, El director del centro de microscopía crioelectrónica de la Universidad de Leeds carga una muestra en uno de los microscopios. Crédito:Universidad de Leeds
El estudio también implicó una colaboración de larga data con el profesor Bob Griffin, del Instituto de Tecnología de Massachusetts, que se especializa en otro método de análisis biológico avanzado de materia biológica:resonancia magnética nuclear de estado sólido.
El profesor Radford dijo:"Durante las últimas seis décadas desde que se crearon las primeras imágenes de microscopía electrónica de amiloide, Los científicos han pasado de trabajar con imágenes borrosas de baja resolución a nuestras imágenes y estructuras tridimensionales nítidas, gracias a los avances modernos en microscopía crioelectrónica.
"Ahora sabemos exactamente dónde está cada punto y punto en la proteína, es posible que podamos desarrollar compuestos que se adhieran firmemente a él, o interrumpirlo, y descubra cómo las fibras contribuyen a la enfermedad. Es el equivalente a pasar de intentar que dos globos se peguen juntos a tener dos engranajes girando perfectamente entre sí.
Añadió:"Hemos utilizado la microscopía crioelectrónica no solo para descubrir la forma y estructura de las proteínas amiloides, sino también cómo crecen y se entrelazan entre sí como los soportes de una cuerda para formar conjuntos más grandes. Este conocimiento va a ser crucial para saber cómo lidiar con ellos ".
El profesor Ranson dijo:"Hasta hace aproximadamente un año, Los científicos sabían que la estructura se parecía más o menos a una escalera, pero ahora hemos demostrado que es mucho más complejo que eso. Ahora estamos comenzando a ver cómo las diferentes proteínas se pliegan en diferentes formas y cómo varían con cada enfermedad que causan.
"El detalle adicional que hemos descubierto significa que podemos comenzar a comprender las capacidades de estas proteínas como causantes de enfermedades.
Añadió:"También se sabe que las fibras amiloides tienen la resistencia del acero, y, ahora entendemos sus estructuras. Podríamos crear nuevos biomateriales inspirados en sus estructuras. Este es un gran ejemplo de cómo la microscopía crioelectrónica puede tener ventajas adicionales ".
Conociendo la estructura de la proteína con el nivel de detalle que han proporcionado los investigadores de Leeds, y medir esas diferencias en diferentes tipos de enfermedad amiloide y diferentes pacientes, también podría permitir a los médicos mostrar quién correría mayor riesgo, lo que significa que el tratamiento puede dirigirse a quienes más lo necesitan.
El siguiente paso para la comunidad científica es comenzar a identificar y desarrollar inhibidores, compuestos que pueden controlar el ensamblaje de proteínas en amiloide. El profesor Radford ha obtenido casi 2 millones de libras esterlinas de Wellcome para llevar a cabo esta etapa de desarrollo.
Más ensayos de laboratorio, ensayos clínicos, La aprobación regulatoria y la participación de un desarrollador de medicamentos aún serían necesarias antes de que los medicamentos pudieran comercializarse. pero los importantes avances en la claridad de la imagen y la comprensión de la estructura de plegado de amiloide marcan un gran avance.
El artículo de investigación completo La estructura de una fibrilla de microglobulina β2 sugiere una base molecular para su polimorfismo amiloide se publica en Comunicaciones de la naturaleza .