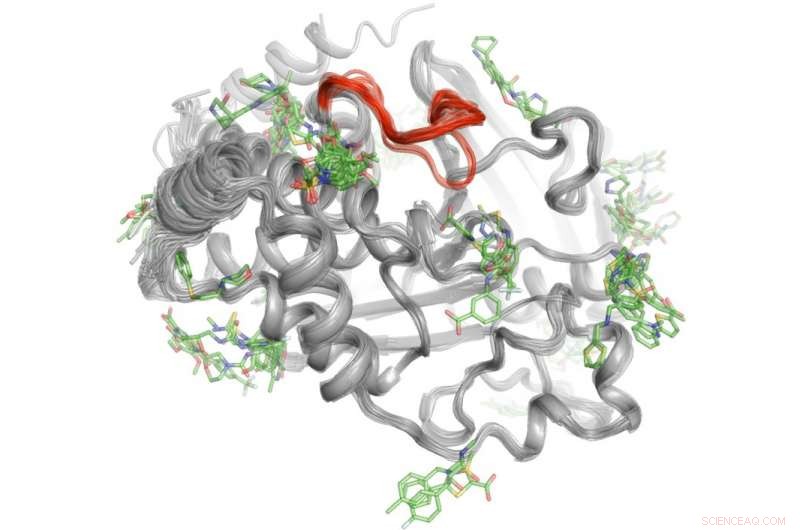
Un método de alto rendimiento revela dónde se unen más de 100 moléculas pequeñas a la proteína PTP1B. Algunas de estas áreas de enlace pueden enviar señales al sitio activo (rojo) para controlar la actividad de PTP1B ". Crédito:Daniel Keedy
Las proteínas de nuestro cuerpo son estructuras sofisticadas que realizan trabajos específicos para mantenernos funcionando y saludables. En muchos casos, Estas diminutas máquinas se encienden o apagan mediante un proceso de dos pasos en el que una parte de la proteína envía mensajes a otra parte llamada "sitio activo". "desencadenando que la proteína comience o detenga su trabajo. A veces, este proceso, conocido como alosterio, se interrumpe, que conduce o contribuye al desarrollo de ciertas enfermedades.
Comprender cómo se conecta una proteína podría ayudar a los investigadores a desarrollar formas de controlar su actividad, y científicos del Advanced Science Research Center (ASRC) en The Graduate Center, CUNY, creen que han encontrado una forma confiable de determinar esto, según un estudio recientemente publicado en eLife .
"Al igual que es difícil adivinar cómo se conecta un interruptor de luz a una bombilla en una habitación sin ver detrás de las paredes, es difícil predecir qué área remota de una proteína está conectada a su sitio activo sin ver los detalles dentro de la estructura, "dijo Daniel Keedy, profesor asistente de la Iniciativa de Biología Estructural de la ASRC y de los departamentos de química y bioquímica del City College of New York.
Para resolver este misterio Keedy y sus colegas exploraron las capacidades de señalización de la proteína tirosina fosfatasa 1B (PTP1B), que los investigadores creen que juega un papel importante en la diabetes tipo 2 y posiblemente en el cáncer de mama. Primero usaron cristalografía de rayos X a diferentes temperaturas para ver cómo se mueven los átomos dentro de la proteína. Esto reveló áreas específicas donde los átomos se mueven como limpiaparabrisas o un juguete de cuna de Newton para enviar mensajes. Próximo, el equipo realizó experimentos de alto rendimiento con la proteína para determinar qué moléculas pequeñas se unen a estos sitios de señalización.
"Este proceso de dos pasos nos permitió ver no solo dónde se origina la señalización dentro de PTP1B, pero también qué pequeñas moléculas son capaces de enviar mensajes al sitio activo. Este conocimiento podría algún día ayudarnos a desarrollar terapias que envíen mensajes específicos para controlar la actividad de una proteína e interrumpir el desarrollo de la diabetes tipo 2. "dijo Keedy.
"Estoy muy interesado en las posibles aplicaciones del trabajo de Daniel, "dijo Kevin Gardner, director de la Iniciativa de Biología Estructural de ASRC y Profesor Einstein de Química y Bioquímica en City College. "Esta técnica proporciona una ruta experimental poderosa para preguntar dónde pueden unirse las moléculas pequeñas a los objetivos de las proteínas, permitiendo el descubrimiento y desarrollo de fármacos al mostrar dónde se podrían encontrar 'puntos de apoyo' previamente imprevistos para que los compuestos se unan y controlen la actividad de las proteínas ".
Keedy y sus colegas hasta ahora solo han analizado PTP1B, pero su método utiliza tecnologías fácilmente disponibles que pueden usarse para estudiar el proceso de alosterio en muchas otras proteínas importantes dentro de nuestros cuerpos. Esperan obtener una nueva comprensión de cómo se controlan las funciones de estas otras proteínas, que podría ser útil para el desarrollo futuro de nuevas terapias farmacológicas.